ترک تنشی خوردگی آلیاژ تیتانیوم در محیط های مایع حاوی کلوراید
آلیاژ Ti Al-1 Mo-1 V در حلال های حاوی یون های کلوراید، بوروماید و یداید تست شد. کشف شد که برای تعدادی حلال ها سرعت مسطح منطقه 2 می تواند با عکس ویسکوزیته مرتبط باشد. به احتمال زیاد این نشانه اثر ویسکوزیته بر ضریب نفوذ بعضی از عناصر متداخل در یک فرایند انتقال جرم است که رشد ترک را محدود می کند. تست های مرتبط نیز که در هر کدام پتانسیل، PH و غلظت کلوراید متغیر است، در محلول های مورد استفاده برای تست های ویسکوزیته، انجام گرفت. نتیجه این تست ها آن بود که غیاب حفاظت کاتدی در برابر ترک خوردگی در محلول ها با PH پایین، ناشی از یک اثر اهمی بوده که نوک ترک را از کنترل پتانسیل خارجی جدا می سازد.
مقدمه
ترک تنشی خوردگی آلیاژهای تیتانیوم یا هر ماده دیگری موضوعی پیچیده است به عنوان مثال سایز مورد آزمایش می تواند از شکست قطعات بزرگ تا تفسیر اتمی رخدادها در نوک یک ترک پیشرو متغیر باشد. در بررسی های جامع اخیر، بازه مورد بررسی نشان داده شده و اثبات شده است که متغیرهای بی شمار، امکان ارائه هر گونه توضیحات واقعا کامل و کمی از SCC را حداقل در آینده نزدیک صلب می کند. بنابراین در انتخاب هر جنبه ای از مسئله، باید به محدودیت های آزمایشگاهی و تئوری ظهور کننده از تحقیق پی برد. کاری که در این مقاله شرح داده می شود، تلاش برای توضیح عوامل کنترل کننده ای است که سرعت مسطح ترک تنش خوردگی در بعضی سیستم ها را تعیین می کند. خاستگاه این مسئله را می توان با بررسی شکل 1 که نشان دهنده بازه وسیع سرعت های مسطح یک آلیاژ در محیط های مختلف است، درک کرد. باید توجه شود که این محیط ها شامل مایعات و گازها هستند و در واقع اگر نتایج تردی کادمیوم نیز موجود بود، نتایج شامل محیط های جامد نیز می شد. تعمق در شکل 1 این سوال را در ذهن ایجاد می کند که عوامل کنترل کننده سرعت مسطح چه بوده و آیا شایسته مطالعه بیشتر می باشد. مشخص است که تنها یک مشخصه فیزیکی نمی تواند پایه توضیحی برای سرعت رشد باشد به عنوان مثال درک ارتباط بین جیوه مایع، نمک های هالیدی مذاب و گاز هیدروژن مشکل خواهد بود. بنابراین یک محدودیت اولیه بر بازه این آزمایشات قرار داده شد و این مقاله تنها ترک خوردگی در محیط های مایع را بررسی می کند.
نتیجه گیری
برای شرایط بررسی شده یعنی Ti-8 Al-1 Mo-1 V (Cº 820 WQ) تست شده در حلال های شامل کلرید، برمید و یدید، به صورت تجربی اثبات شد که:
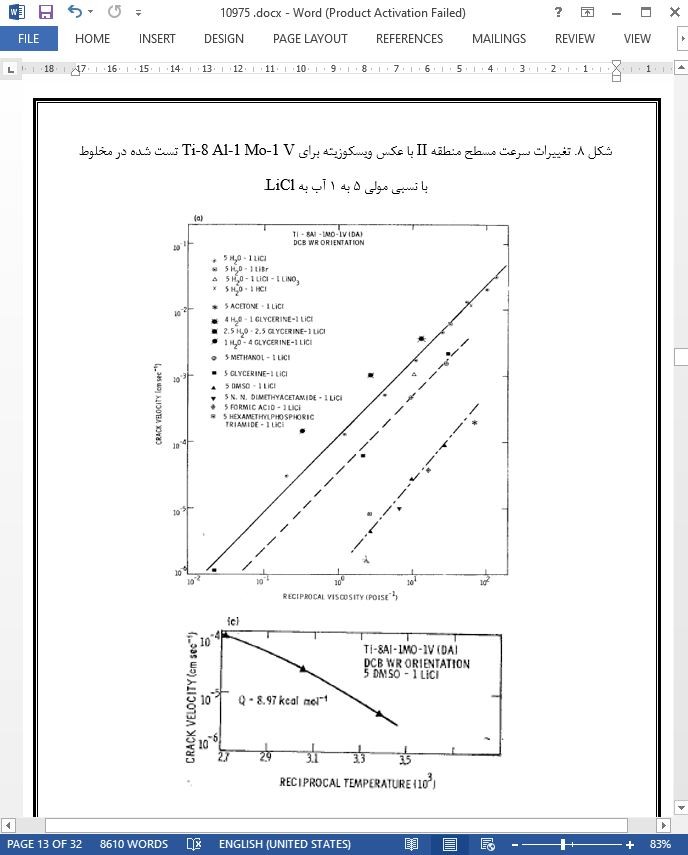
1. سرعت مسطح منطقه II با عکس ویسکوزیته تغییر می کند.
2. انرژی اکتیواسیون برای سرعت مسطح منطقه II، وابستگی دمایی یکسانی همانند ویسکوزیته نشان می دهد.
3. سرعت مسطح در حلال های مختلف را می توان با هدایت محلول مرتبط ساخت.
4. مخلوط کردن حلال ها باعث ایجاد نتایج غیر افزایشی بر روی ویسکوزیته و هدایت می شود.
Ti-8 Al-1 Mo-1 V was tested in solvents containing chloride, bromide or iodide ions. It was found that the region II plateau velocity could be correlated with the inverse of the viscosity for several solvents. It seems most likely that this reflects the influence of the viscosity on the diffusion coefficient of some species involved in a mass transfer process which limits the crack growth. Associated tests were performed in which the potential, pH and concentration of Cl− were varied, in some of the same solutions as used for the viscosity tests. It is concluded from these tests that theabsence of cathodic protection against cracking in solutions of low pH arises from an ohmic effect which isolates the crack tip from external potential control.
1. Introduction
Stress corrosion cracking (SCC) of titanium alloys, or any material, is a complex subject - for example, the scale (size) that may be examined ranges from the failure of large structures to atomistic descriptions of events at a propagating crack tip. In recent comprehensive reviews [1, 2] the range of the subject was demonstrated and it was shown that the myriad variables render any really complete and quantitative description of SCC unlikely at least in the near future. Thus, in selecting any aspect of the problem the constraints on experimental and theoretical analyses emerging from the investigation must be realized. The work which is described in this paper is an attempt to explain the controlling factors that determine the plateau velocity of a stress corrosion crack in some systems. The origin of this problem can be understood by examination of Fig. 1 which illustrates the extensive range of plateau velocities which may be observed in one alloy tested in various environments. It is noted that these environments contain liquids and gases, and in fact, if results for cadmium embrittlement [3] were present, could also include solid environments. Contemplation of Fig. 1 raised the obvious question of the factor(s) that control the plateau velocity and the point was selected as being worthy of further study. It was clear that one single physical property could not form the basis of an explanation of growth velocity - for example, it is difficult to see the connection (if any) between liquid mercury, molten halide salts and hydrogen gas. Thus, an initial restriction was placed on the range of these experiments and this paper only considers cracking in liquid environments.
6. Conclusions
For the conditions investigated, i.e. Ti-8 AI-1 Mo-1 V (820~ WQ) tested in solvents containing chloride, bromide or iodide ions, it was established experimentally that:
1. the region II plateau velocity varies inversely with the viscosity;
2. the activation energy for the region II plateau velocity shows the same temperature dependence as that for viscosity;
3. the plateau velocity in the several solvents may be correlated with the solution conductivity;
4. mixing the solvents gives non-additive results both on a viscosity and a conductivity basis.
1 مقدمه
2 سیستم های مورد بررسی
2.1 آلیاژ
2.2 محلول ها
3 آزمایشات
4 نتایج
4.1 اثر پتانسیل بر سرعت رشد ترک
4.2 ارتباط ویسکوزیته-سرعت مسطح
4.3 ارتباط سرعت مسطح – هدایت
4.4 محلول های حاوی کلورین غیر یونی
4.5 تست های تکمیلی
4.6 مقدار KISCC
5 بحث
5.1 اثر پتانسیل
5.2 اثر ویسکوزیته و هدایت
5.3 جریان سیالات
5.4 نفوذ همرفتی (انتقال جرم)
5.5 هدایت
6 نتیجه گیری
1. Introduction
2. Systems investigated
2.1. Alloy
2.2. Solutions
3. Experimental
4. Results
4.1. Effect of potential on crack propagation velocity
4.2. Plateau velocity-viscosity correlations
4.3. Plateau velocity-conductivity correlation
4.4. Solution containing non-ionic chlorine
4.5. Supplementary tests
4.6. The value of K~sec
5. Discussion
5.1. Influence of potential
5.2. Influence of viscosity and conductivity
5.3. Fluid flow
5.4. Convective diffusion (mass-transfer)
5.5. Conductivity
6. Conclusions
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه