ژن درمانی سرطان با هدف قرار دادن ساز و كار خزان ياخته ای
چكيده
كشف سازوكار خزانياختهاي، اهداف نويني براي درمان سرطان طرح مي كند، و معلوم شده است كه ژندرماني با هدف قرار دادن اين سيستم خودكشيگرا، ميتواند سلولهاي توموري را به صورت مجزا و بدون ايجاد التهاب از ميان بردارد. سازوكار خزانياختهاي را ميتوان با استفاده از ژني كه رمزگذاري يك آغازگر، ميانجي يا مجريِ مرگ خزانياختهاي را انجام مي دهد، يا با جلوگيري از بيان ژن ضدخزانياخته، مورد هدف قرار داد. روشهايي كه سلولهاي سرطاني را مورد هدف قرار ميدهند، از طريق انتقال ژنهاي بخصوص، بيان ژنهاي خاص، يا ترشح پروتيينهاي مورد نظر از طريق دستكاري ژنتيكي سلولهاي مشتق از خود، نتيجهي درمان خزانياخته محورِ ژندرمانيِ سرطان را تعيين ميكنند. با وجود اينكه موفقيتهاي باليني تا كنون محدود بودهاند، ژندرماني با هدفِ سازوكار خزانياختهاي، پتانسيل بالايي براي كمك به بيماران داراي تومورهاي خطرناك دارد، به شرط آن كه سيستمهاي پربازده و مشخصي براي انتقال و مديريت ژن در دسترس باشد.
مقدمه
ژندرماني، شيوه درماني قطعي است كه در آن DNA يا RNA مستقيما به سلولهاي درونتني منتقل ميشوند، يا به سلولهاي ايزوله منتقل و سپس دوباره به بدن انسان تزريق ميشوند. 1 به دليل اثربخشي نامناسب و مسموميت فراگير غيرقابل اجتناب پرتودرماني و شيمي درمانيهاي رايج، سرطان جزو بزرگترين خطراتي است كه سلامت انسان را تهديد مي كند. از اين رو، ژندرماني جايگاه خود را در درمان توموري بافتهاي متفاوت پيدا كردهاست. 2 ممكن است بتوان سلولهاي سرطاني را با استفاده از ژنهاي پروتيينهاي سمي يا پروتيينهاي سركوبگر تومور، يا تركيبي از يك رده ژن خودكشي و پيشدارو، اصلاح كرد. اين روشها هر دو مرگ سلولي مستقل را در پي دارند. يك روش جايگزين اين است كه با استفاده از دستكاري ژنتيكيِ سلولهاي بدخيم يا سلولهاي ايمني براي توليد سيتوكين يا آنتيژنهاي تومور، واكنش ايمني ضدتومور را برانگيزيم. 5و6 با اين حال، با توجه به سطح ايمني نسبتا پايين در بيماران سرطاني، راهبردهايي كه سلولهاي تومور را مستقيما از بين ميبرند در مورد محيطهاي كوچكي كه توسط تومور تعليم داده شدهاند، برتري دارند.
آزمايشها و ديدگاههاي باليني
به لطف پيشرفت در مطالعات آزمايشگاهي ژندرماني سرطان با هدف دستگاه خزان ياختهاي، پزشكان امروزه فرصتهايي براي ارزيابي قابليتهاي درماني فهرست طويلي از واكنشگرهاي ناب ژن موافق با خزان ياخته براي درمان بيماران سرطاني در اختيار دارند. 7،61،62 به دليل نقش مبهم TNF-a در التهاب و رشد سرطان، هنوز جاي بحث است كه آيا TNF-a پتانسيل كمك به بيماران سرطاني را دارد يا خير. اخيرا كشف شد كه TNF-a نقش اساسي در تنظيم نفوذپذيري عروقي دارد، و اين باعث پيچيدهتر شدن مساله ميشود. در مقابل موفقيت محدودِ پروتيينِ نوتركيبِ TNF-a به دليل سميت بالا، مشخص شده كه نوعي از TNF-a اگر توسط آدنوويروس منتقل شود كه به آن TNFerade ميگويند، قابليتهاي درماني بالايي براي تومورهاي جامد پيشرفته، متاستازي يا عودكننده دارد، از جمله در سرطان لوزالمعده، مري، ساركوماي بافت نرم و ملانوما. 107-112 يك آزمون باليني فاز 3 همراه با شيميپرتودرماني (CRT) در سرطان موضعي پيشرفتهي لوزالمعده، نشان داد كه شانس بقاي گروه درمان شده با TNF در مقايسه با گروهي كه فقط CRT دريافت كردند، به طور اميدواركنندهاي بالاست .(جدول 1)107
Abstract
The unraveling of cellular apoptosis machinery provides novel targets for cancer treatment, and gene therapy targeting this suicidal system has been corroborated to cause inflammation-free autonomous elimination of neoplastic cells. The apoptotic machinery can be targeted by introduction of a gene encoding an inducer, mediator or executioner of apoptotic cell death or by inhibition of anti-apoptotic gene expression. Strategies targeting cancer cells, which are achieved by selective gene delivery, specific gene expression or secretion of target proteins via genetic modification of autologous cells, dictate the outcome of apoptosis-based cancer gene therapy. Despite so far limited clinical success, gene therapy targeting the apoptotic machinery has great potential to benefit patients with threatening malignancies provided the availability of efficient and specific gene delivery and administration systems.
Introduction
Gene therapy is the definitive therapeutic practice involving the transferring of DNA or RNA directly to in vivo cells, or to isolated cells followed by reinfusion of these cells into human body.1 Given that cancers are among the most severe threats to human health due to the unsatisfactory efficacy and inevitable systemic toxicity of traditional radio- and chemo-treatment, gene therapy has found its footing in treatment of neoplasia of divergent tissues.2 Cancer cells could be modified with the genes of cytotoxic or tumor suppressor proteins, or with a class of suicidal genes in combination with prodrugs, all of which result in autonomous cell death.3,4 Alternatively, the antitumor immune response could be elicited by genetic modification of malignant cells or immune cells to produce cytokines or tumor antigens.5,6 However, considering the relatively weak immune levels in cancer patients, strategies that directly kill tumor cells are advantageous in the context of microenvironments educated by tumors.7
Clinical trials and perspectives
By virtue of the progress in laboratory studies on cancer gene therapy targeting the apoptotic machinery, clinicians now have the opportunities to evaluate the therapeutic potential of a growing list of pro-apoptotic gene reagents on cancer patients.7,61,62 Due to a confound role of TNF-a in inflammation and cancer development, it remains a debate whether TNF-a potentially benefits cancer patients, which has been even complicated by the recent discovery that TNF-a is critically involved in vascular permeability regulation. In contrast to the limited success of recombinant TNF-a protein due to high toxicity, adenovirus-delivered TNF-a, designated TNFerade, has showed emphatic therapeutic potentials in advanced, metastatic or recurrent solid tumors including pancreatic cancer, esophageal cancer, soft tissue sarcoma and melanoma.107–112 A phase III clinical trial combined with chemoradiation (CRT) in locally advanced pancreatic cancer indicated an encouraging trend of overall survival in favor of the TNF-treated group compared with CRT alone (Table 1).107
چكيده
مقدمه
دستگاه خزان ياختهاي canonical در سلولهاي پستانداران
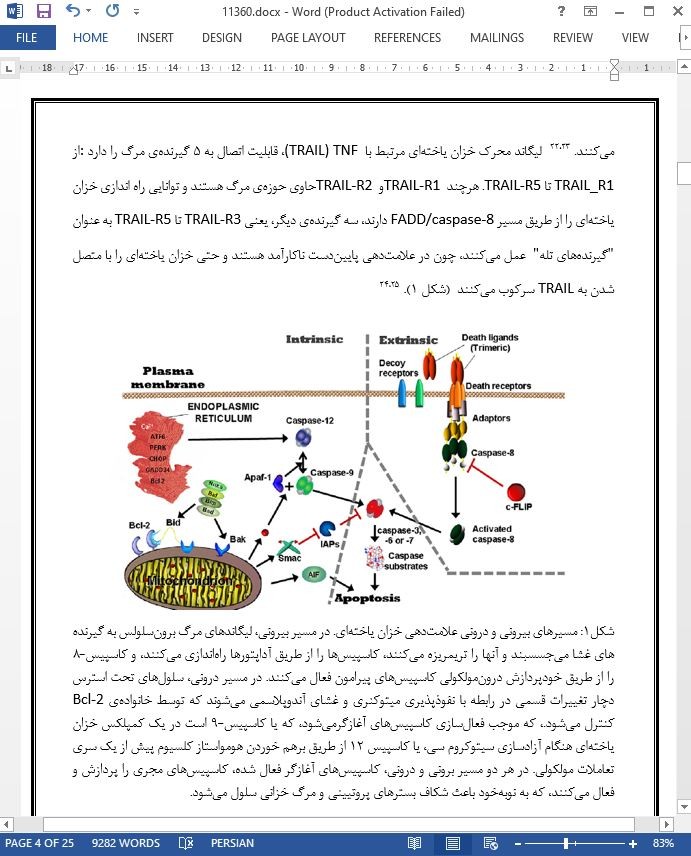
مسيرهاي علامتدهي بيروني از طريق گيرندهي مرگ
مسيرهاي علامت دهی دروني مرتبط با ميتوكندری و شبكه آندوپلاسمی
تنظيمكنندههای علامتدهی خزان ياختهای
خزان ياختهای تنظيم نشده در سرطانزايی
راهكارهايي كه دستگاه خزان ياختهاي را در سلولهاي كارسينوما هدف قرار میدهند
نشانهروی مولكولي: حمله يا دفاع
نشانه روی سلولي: ريسك غير رايج
انتقال بخصوص ژنهاي خزان ياختهای در سلولهاي كارسينوما
بيان گزينشی ژنهای محرك خزان ياخته در سلولهاي كارسينوما
ترشح پروتيينهای موافق خزان ياختهاي متمركز بر تومور توسط سلول هاي اوتولوگوسِ تنظيمشده
آزمايشها و ديدگاههای بالينی
Abstract
Introduction
Canonical apoptotic machinery in mammalian cells
Death receptor-mediated extrinsic signal pathway
Mitochondrion- and endoplasmic reticulum-related intrinsic signal pathways
Regulators of apoptotic signaling
Deregulated apoptosis in carcinogenesis
Strategies targeting the apoptotic machinery in carcinoma cells
Molecular targeting: the spear or the shield
Cellular targeting: the devil but not the normal
Specific delivery of apoptotic genes in carcinoma cells
Selective expression of apoptosis-triggering genes in carcinoma cells
Secretion of tumor-targeted proapoptotic proteins by modified autologous cells
Clinical trials and perspectives
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه