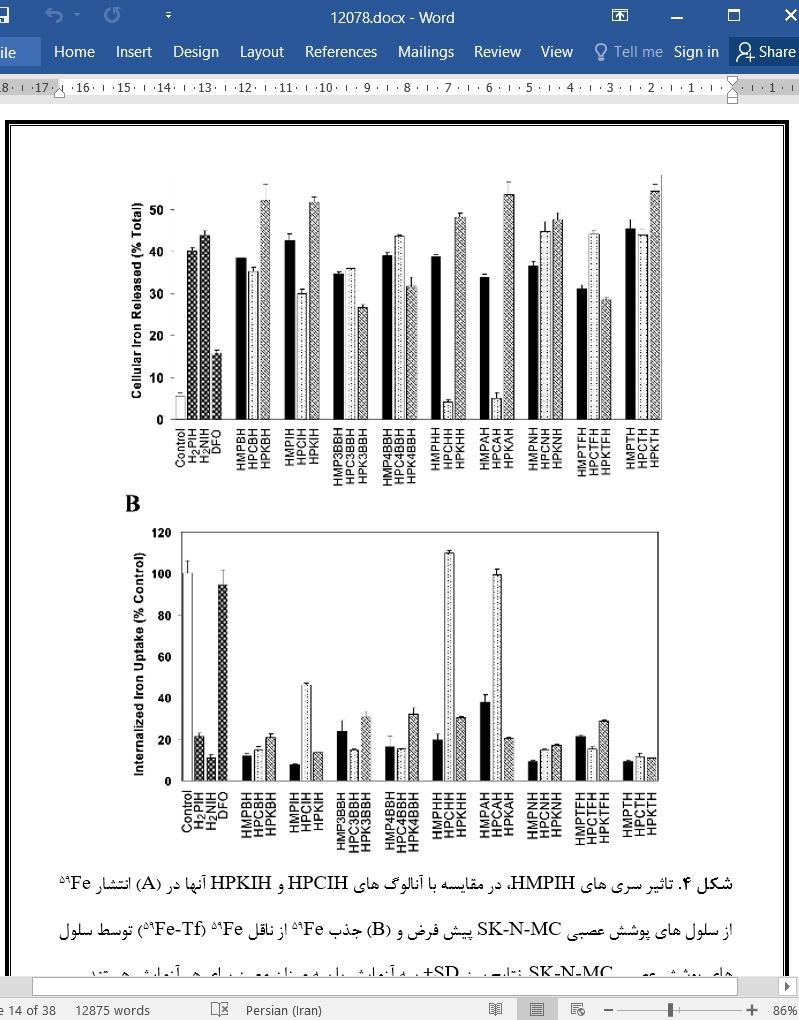
رابطه فعالیتی ساختاری کی لیتورهای آهن جدید، سری های متیل پیرازینیل کتون ایزونیکوتینویل هیدرازون
طراحی کی لیتورهای Fe جدید با اثر انتشار بالای Fe و سمیت پایین در درمان اختلال اضافه بار بیش از حد آهن نقش بسزایی دارد. ما آنالوگ های متیل پیرازینیل کتون ایزونیکوتینویل هیدرازون (HMPIH) را بر اساس کی لیتورهای آرویل درازون که سابقا بررسی شده اند، طراحی و تولید کرده ایم. سری های HMPIH، اثر انتشار بالای Fe از سلول ها و فعالیت ضدتکثیری متوسط را نشان دادند. مهمتر اینکه، سری های جدید اثرات الکتروشیمیایی برگشت ناپذیری داشتند که ناشی از خاصیت الکترون کشندگی N ـ اتم پیرازین غیرکوئوردینانسی می شدند. فعالیت اخیر نقش برجسته ای را در تشکیل کمپلکس های اکسایش کاهش غیرفعال دارند که از تولید اجزاء واکنش پذیر با اکسیژن جلوگیری می کنند. در حقیقت، کمپلکس های Fe سری های HMPIH از اکسیداسیون آسکوربات و هیدرولیزاسیون بنزوئات پیشگیری می کنند. ما در این مقاله نشان داده ایم که ترکیب گروه های الکترون کشنده در طراحی N,N,O- آرویل هیدرازون ها به عنوان داروی مدنظر جهت درمان اختلال اضافه بار بیش از حد Fe دارای اهمیت می باشد.
مقدمه
طراحی و تولید کی لیتورهای آهن جدید برای درمان اختلالات اضافه بار بیش از حد Fe از قبیل تالاسمی β بسیار مهم است5-1، زیرا درمان این اختلالات با کی لیتورهای کلینیکی مانند دیس فری اگزامین ها (DFOa؛ شکل 1A)، تا حدودی به علت خاصیت آبدوستی بالای آن مضرات زیادی دارند.5،6 این موضوع سبب جذب ضعیف از مجرای معدی – روده ای می شود، که برای رسیدن به تعادل Fe منفی مستلزم تزریق زیرجلدی 24-12 ساعت در روز و 6-5 بار در هفته می باشد.7 بعلاوه، یک سوم بیماران درمان شده با DFO، در محل تزریق دچار درد و تورم می شوند.8،9 روی هم رفته، این مشکلات موجب شدند که بیماران ناچیزی از این دارو استقبال کنند.
The design of novel Fe chelators with high Fe mobilization efficacy and low toxicity remains an important priority for the treatment of Fe overload disease. We have designed and synthesized the novel methyl pyrazinylketone isonicotinoyl hydrazone (HMPIH) analogs based on previously investigated aroylhydrazone chelators. The HMPIH series demonstrated high Fe mobilization efficacy from cells and showed limited to moderate antiproliferative activity. Importantly, this novel series demonstrated irreversible electrochemistry, which was attributed to the electron-withdrawing effects of the noncoordinating pyrazine N-atom. The latter functionality played a major role in forming redox-inactive complexes that prevent reactive oxygen species generation. In fact, the Fe complexes of the HMPIH series prevented the oxidation of ascorbate and hydroxylation of benzoate. We determined that the incorporation of electron-withdrawing groups is an important feature in the design of N,N,O-aroylhydrazones as candidate drugs for the treatment of Fe overload disease.
Introduction
The synthesis and design of novel iron (Fe) chelators is of great importance for the treatment of Fe-loading diseases such as β-thalassemia major.1–5 This is due to the fact that treatment with the clinically used chelator, desferrioxamine (DFOa ; Figure 1A), suffers many drawbacks that are partly caused by its high hydrophilicity.5,6 This leads to poor absorption from the gastrointestinal tract, which necessitates subcutaneous administration for 12–24 h/day, 5–6 times/week to achieve a negative Fe balance.7 In addition, a third of all patients treated with DFO experience swelling and pain at the injection site.8,9 Cumulatively, these problems lead to poor patient compliance.
مقدمه
بحث و نتایج
نتایج
بخش آزمایشی
منابع
Introduction
Results and Discussion
Conclusions
Experimental Section
References
- اصل مقاله انگلیسی با فرمت ورد (word) با قابلیت ویرایش
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه