دانلود مقاله تشخیص سرطان پروستات با استفاده از نانو حباب های لیپیدی حامل آپتامر A10-3.2 ضد PSMA
چکیده
در این مطالعه نانوحباب هدفمند لیپیدی حامل آپتامر A10-3.2 ضد آنتیژن اختصاصی غشایی پروستات ساخته شد و تأثیر آن در تصویربرداری سونوگرافی سرطان پروستات بررسی شد. موادی که برای نوسان مکانیکی استفاده شد، عبارتند از: 2-دی پالمیتول-سن-گلیسرو-3- فسفوکولین، 1,2- دی پالمیتول-سن-گلیسرو -3-فسفاتیدیک اسید، 1,2- دی پالمیتول-سن-گلیسرو-3-فسفواتانولامین، 1,2-دی پالمیتول-سن-گلیسرو-3- فسفوگلیسرول، کربوکسیل دستکاری شده 1,2-دی استریول- سن- گلیسرو-3- فسفواتانولامین و پلی اتیلن گلیکول-2000 و نانو حبابها از طریق روش سانتریفیوژ شناوری تهیه شدند. پس از این نانوحبابها به موشها تزریق شد که تصویربرداری رنگی داپلر جریان خون شکم بطور چشمگیری بهبود یافت. با وجود تزریق نرمال سالین به بطن چپ به منظور تخلیه نانوحبابهای موجود در خون، نانوحبابها در بخشهای بافت توموری باقی مانند که مشخص کرد نانوحبابها میتوانند از طریق نفوذپذیری و اثر احتباس به فضاهای بافتی وارد شوند. آپتامرهای A10-3.2 ترکیب شده با فلوئور که از طریق سنتز شیمیایی بدست آمدند، برای سلولهای PSMA مثبت ویژگی مناسبی را نشان دادند و این آپتامرها به منظور ایجاد نانوحبابهای هدفمند، از طریق واکنش آمید به مولکولهای لیپیدی کربوکسیل دستکاری شده 1,2-دی استریول- سن- گلیسرو-3- فسفواتانولامین روی پوسته بیرونی نانوحبابها متصل شدند. الکتروفورز ژل و ایمونوفلورسانس تأیید کردند که نانوحبابهای هدفمند بطور موفقیت آمیز ساخته شدند. در مرحله بعد، با استفاده از آزمایشات ترکیبشوندگی برون تنی و فلوسایتومتری در سطح سلولی نانوحبابهای هدفمند توانستند با سلولهای PMSA مثبت (سلولهایC4-2) ترکیب شوند در حالیکه با سلولهای PMSA منفی (سلولهایPC-3) ترکیب نشدند. در نهایت، برای مشاهده تغییرات پارامترهای نانوحبابهای هدفمندو غیرهدفمند در حالت سونوگرافی کنتراست بهبودیافته و توزیع نانوحبابهای هدفمند رنگآمیزی شده با Cy5.5 در تصویربرداری فلورسانس جانداران کوچک از زنوگرافتهای C4-2 و PC-3 در موشها استفاده شد. مقایسه شاخصهای سونوگرافی میان نانوحبابهای هدفمند و غیر هدفمند در زنوگرافتهای C4-2 نشان دادند که نانوحبابها زمانهای اوج مشابهی داشتند (p>0.05) در حالیکه شدت اوج، نیمه زمان شدت اوج و سطح زیر منحنی 1/2 شدت اوج اختلاف معناداری داشتند (p<0.05). در زنوگرافتهای PC-3، این چهار شاخص هیچگونه اختلافی را نشان ندادند. تصویربرداری فلورسنت توانایی تجمع نانوحبابهای هدفمند را در تومورهای زنوگرافت C4-2 نشان داد. در نتیجه، نانوحبابهای هدفمند حامل آپتامر A10-3.2 ضد PSMA در سرطان پروستات اثر تصویربرداری مشخص و هدفمندی دارند.
مقدمه
با درک عمیق مواد حاجب سونوگرافی (UCAs) و توسعه علم مواد، پوسته بیرونی UACs را میتوان براساس نیازهای مختلف از موادی مانند اجزای لیپیدی، آلبومین دناتوره (ALB) و پلیمرها را تولید کرد. در هر حالتی این پوسته بیرونی لیپیدی مرسومترین و مناسبترین جز مواد حاجب تشخیصی به دلیل ویژگیهای مشترک انعطافپذیری عالی، دستکاری آسان مولکولهای لیپیدی و عدم سیمت برای انسان تلقی میشود. براساس این خصایص، گروهی در مولکولهای لیپیدی به آسانی به لیگاندهای مختص به مولکولهای مدنظر مانند ترکیبات دارای وزن پایین مولکولی و آنتیبادیها متصل میشوند. در این روش، اجزا پوسته بیرونی UACهای لیپیدی هدفنمد ساخته شدند که یک جزء کلیدی در تصویربرداری مولکولی سونوگرافی نیز به شمار میآید. با این وجود، مطالعات اخیر درباره تصویربرداری مولکولی سونوگرافی عمدتاً روی تشخیص سونوگرافی هدفمند ترمبوز، التهاب و تومورها کار کردهاند. نانوحباب (NB) سونوگرافی لیپیدی در حال ظهور یک UCA است که اندازه ذرهای آن کوچکتر از 1000 نانومتر است و میتواند بر محدودیتهای نانوحبابهای سونوگرافی قدیمی انحصاراً در عروق خونی غلبه کند. UCAهای در مقیاس نانو را میتوان در بافتهای توموری برای تراوایی و اثرات احتباس تومورها مانند فواصل اندوتلیالی بزرگتر، فقدان غشای پایه و تخلیه ضعیف لنف در تومورها برای ورود به فضاهای خارج سلولی به منظور تصویربردای از پارانشیم تومور بکار گرفت.
نتیجهگیری
در این مطالعه یافتههای قبلی خود را با مزایای آپتامرهای دارای وزن مولکولی پایین و ویژگی عالی ترکیب کردیم و سپس روش اتصال واکنش زنجیره آمید ایمن را برای ایجاد نانوحبابهای هدفمند حامل آپتامر A10-3.2 ضد PSMA استفاده کردیم. این نانوحبابها ایمن بودند و از توانایی نفوذ عالی، ویژگی بالا و پتانسیل ترجمه یا کاربرد بالینی برخوردار بودند. این مطالعه نه تنها اصلی را برای تصویربرداری مولکولی سرطان پروستات بلکه روشهایی را برای ایجاد ابزار کاوشگر سونوگرافی هدفمند حامل آپتامرها را نیز ارائه میدهد. علاوه بر این، از آنجایی که آپتامر به خودی خود یک قطعه ژنی است، میتواند با آنتراسایکلینها ترکیب شود یا به سایر قطعات ژنی متصل شود و میتواند پایهای را برای ایجاد نانوحبابهای هدفمند حامل داروها (یا ژنها) آینده در درمان هدفمند تحت تشعشع سونوگرافی بنا کند.
Abstract
In this study, the lipid targeted nanobubble carrying the A10-3.2 aptamer against prostate specific membrane antigen was fabricated, and its effect in the ultrasound imaging of prostate cancer was investigated. Materials including 2-dipalmitoyl-sn-glycero-3-phosphocholine, 1,2-dipalmitoyl-sn-glycero-3-phosphatidic acid, 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine, 1,2-dipalmitoyl-sn-glycero-3-phosphoglycerol, carboxyl-modified 1,2-distearoyl-sn-glycero3-phosphoethanolamine, and polyethyleneglycol-2000 were for mechanical oscillation, and nanobubbles were obtained through the centrifugal flotation method. After mice were injected with nanobubbles, abdominal color Doppler blood flow imaging significantly improved. Through left ventricular perfusion with normal saline to empty the circulating nanobubbles, nanobubbles still existed in tumor tissue sections, which demonstrated that nanobubbles could enter tissue spaces via the permeability and retention effect. Fluorinated A10-3.2 aptamers obtained by chemical synthesis had good specificity for PSMA-positive cells, and were linked with carboxyl-modified 1,2-distearoyl-sn-glycero-3-phosphoethanolamine lipid molecules from the outer shell of nanobubbles via amide reaction to construct targeted nanobubbles. Gel electrophoresis and immunofluorescence confirmed that targeted nanobubbles were fabricated successfully. Next, targeted nanobubbles could bind with PSMA-positive cells (C4-2 cells), while not with PSMA-negative cells (PC-3 cells), using in vitro binding experiments and flow cytometry at the cellular level. Finally, C4-2 and PC-3 xenografts in mice were used to observe changes in parameters of targeted and non-targeted nanobubbles in the contrast-enhanced ultrasound mode, and the distribution of Cy5.5-labeled targeted nanobubbles in fluorescent imaging of live small animals. Comparison of ultrasound indicators between targeted and non-targeted nanobubbles in C4-2 xenografts showed that they had similar peak times (P.0.05), while the peak intensity, half time of peak intensity, and area under the curve of ½ peak intensity were significantly different (P,0.05). In PC-3 xenografts, there were no differences in these four indicators. Fluorescent imaging indicated that targeted nanobubbles had an aggregation ability in C4-2 xenograft tumors. In conclusion, targeted nanobubbles carrying the anti-PSMA A10-3.2 aptamer have a targeted imaging effect in prostate cancer.
Introduction
With the in-depth understanding of ultrasound contrast agents (UCAs) and the development of material science, the outer shell of UCAs can be constructed of materials such as lipid components, denatured albumin (ALB), and polymers based on different needs.1 Of all, the lipid outer shell is the most classic and most appropriate component of diagnostic contrast agents, due to the common features of excellent elasticity, easy modification of lipid molecules, and non-toxicity to humans.2 Based on these traits, groups in lipid molecules are easily linked with ligands specific to molecules of interest, such as compounds with small molecular weight and antibodies. In this way, outer shell components of targeted lipid UCAs were fabricated, which is also a key part in ultrasound molecular imaging.3 However, current studies about ultrasound molecular imaging are mainly applied in targeted ultrasound diagnosis of thrombosis, inflammation, and tumors.4–7 The newly emerging lipid ultrasound nanobubble (NB) is a UCA with a particle size smaller than 1,000 nm, which can overcome the limitations of traditional ultrasound microbubbles exclusively in blood vessels.8 Nano-scale UCAs in tumor tissues can utilize the permeability and retention effects of tumors, such as larger endothelial gaps, lack of a basement membrane, and poor lymph drainage in tumors, to enter extravascular spaces to achieve imaging of tumor parenchyma.9,10
Conclusion
In this study, we combined our previous findings with the advantages of the small molecular weight and excellent specificity of aptamers, and then used the safe amide reaction connection method to construct targeted NBs carrying the anti-PSMA aptamer A10-3.2. These were safe and had excellent penetration ability, strong specificity, and potential for clinical translation.39,40 This study can not only provide a basis for ultrasound molecular imaging of prostate cancer, but can also provide methods for constructing targeted ultrasound probes carrying aptamers. In addition, because the aptamer is a gene fragment in itself, it can be intercalated with anthracyclines or can be connected to other gene fragments, which can lay the foundation for future construction of targeted NBs carrying drugs (or genes) in targeted therapy under ultrasound irradiation.41–44
چکیده
مقدمه
مواد و روش کار
تهیه نانوحبابها
ساخت مدلهای کشت سلولی تحت برونتنی و مدلهای حیوانی زنوگرافت تومور
تصویربرداری و نفوذ توانایی نانوحبابها در موشهای نود
سنتز و ویژگی آپتامر A10-3.2
تهیه و آزمایش درستی نانوحبابهای هدفمند
اعتبارسنجی ظرفیت هدفمندی نانوحبابها در سطح سلولی در شرایط برون تنی
تصویربرداری سونوگرافی و تصویربرداری فلورسانس جانداران کوچک در موشهای متحمل تومور
تشخیص بیان PSMA در تومورهای زنوگرافت
تجزیهوتحلیل آماری
نتایج
CDFI و تراوایی نانوحبابها در موشها
سنجش درستی ویژگی آپتامر
شناسایی و خصوصیات نانوحبابهای هدفمند
سنجش درستی ترکیبشوندگی میان نانوحبابهای هدفمند و سلولها در شرایط برون تنی
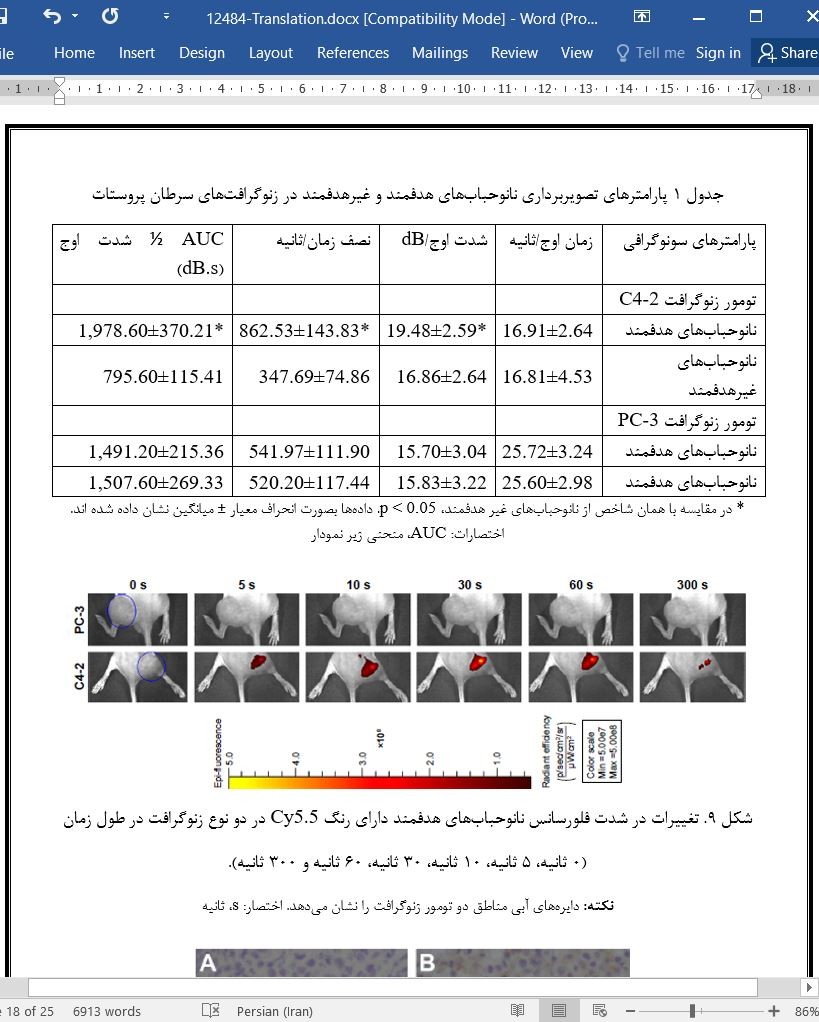
CEUS و تصویربرداری فلورسانس دورن تنی در تومورهای زنوگرافت
بحث
نتیجهگیری
منابع
Abstract
Introduction
Materials and methods
Preparation of NBs
Construction of in vitro cell culture and tumor xenograft animal models
Imaging and penetration ability of NBs in nude mice
Synthesis and the specificity of the A10-3.2 aptamer
Preparation and validation of targeted NBs
Validation of the targeting capacity of NBs in vitro at the cell level
Ultrasound imaging and fluorescence imaging of live small animals in tumorbearing mice
Detection of PSMA expression in xenograft tumors
Statistical analysis
Results
CDFI and permeability of NBs in mice
Validation of specificity of aptamers
Identification and characteristics of targeted NBs
In vitro validation of binding between targeted NBs and cells
CEUS and the in vivo fluorescence imaging in the xenograft tumors
Discussion
Conclusion
References
- اصل مقاله انگلیسی با فرمت ورد (word) با قابلیت ویرایش
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه