دانلود مقاله استفاده از جاذب نانوسولفید برای حذف موثر جیوه عنصری از گاز ناشی از سوختن زغال سنگ
چکیده
مساحت سطح روی سولفید (Zns) با استفاده از ذرات نانوساختار تولید شده با روش رسوب گیری از فاز مایع به طور موفقیت آمیزی افزایش یافت. سپس رو ی سولفید با بالاترین سطح (نانو-روی سولفید) 196.1 مترمربع بر گرم برای حذف جیوه عنصری (Hg0) از گاز ناشی از سوختن زغال سنگ در دمای نسبتا بالا (140 تا 160 درجه سانتیگراد) استفاده شد. به دلیل زیاد بودن مناطق گوگرد سطحی در نانو-روی سولفید که دارای قابلیت اتصال بسیار بالایی با Hg0 هستند، نانو-روی سولفید ظرفیت جذب Hg0 خیلی بیشتری نسبت به روی سولفید بالک معمولی نشان می-دهد. Hg0 ابتدا روی سطح جادب جذب شد و سپس با گوگرد سطحی مجاور واکنش داده و پایدارترین ترکیب جیوه، HgS، را به وجود آورد که با آنالیز طیف بینی فوتوالکترون پرتو ایکس و یک آزمایش دفع سطحی برنامه ریزی شده با دما تایید شد. در دمای بهینه 180 درجه سانتیگراد،ظرفیت متعادل جذب Hg0 برای نانو-روی سولفید(غلظت Hg0 ورودی برابر با 65 میگروگرم بر مترمکعب بود) از 497.84 میکروگرم بر گرم بیشتر بود. در مقایسه با چند کربن فعال تجاری که به صورت انحصاری برای حذف فاز گازی جیوه استفاده می شوند، نانو-روی سولفید هم در مورد ظرفیت جذب و هم نرخ جذب بهتر عمل کرد. با این عملکرد عالی حذف Hg0، نانو-روی سولفید غیر کربنی می تواند جایگزین مناسب کربن فعال برای حذف Hg0 در نیروگاه های مجهز به دستگاه های کنترل ذرات معلق باشد، همچنین روشی برای استفاده مجدد از خاکستر به عنوان یک منبع ارزشمند به عنوان مثال ماده افزودنی به بتن را نیز پیشنهاد می کند.
مقدمه
فهرست به طور مدام به روز شده آلاینده های هوا تایید می کند که سوختن زغال سنگ همچنان منبع اصلی انتشار ذرات آلاینده است که سالانه حدود 475 تن جیوه منتشر می کند. به علت سمیت بیش از حد جیوه و تجمع زیستی متیل جیوه تغییر شکل یافته از جیوه انتشار یافته، چین و ایالات متحده استانداردهای ملی برای کاهش انتشار جیوه از نیروگاه های با سوخت زغال سنگ را در دسامبر 2011 تصویب کرده اند. جیوه عنصری بسیار فرار است و عمر طولانی در جو دارد، لذا آلاینده زیست محیطی جهانی است. در مارس 2016، 128 کشور، کنواسیون میناتماتا در مورد جیوه را برای حفظ سلامت انسان و محیط زیست از اثرات مضر جیوه از منابع انسانی مثل سوختن زغال سنگ امضا کردند. تکنولوژی های مختلف مثل تزریق کربن فعال (AC)، برای کنترل انتشارات جیوه از سوختن زغال سنگ برای رعایت الزامات مقررات جهانی و منطقه ای جیوه توسعه یافته اند.
تزریق کربن فعال حداکثر تکنولوژی کنترل قابل دستیابی برای جذب جیوه از نیروگاه های زغال سنگ است. با توجه به ظرفیت جذب جیوه از کربن فعال خام، چند اصلاح شیمیایی از جمله اشباع گوگرد، کلر و برم در حال حاضر برای افزایش ظرفیت جاذب جیوه از کربن فعال در حال توسعه است که در بالای دستگاه های کنترل ذرات معلق، که یا رسوب سازهای الکترواستاتیک و یا فیلتر های سبک بافت هستند، تزریق می شوند. برای مثال، کربن های اشباع شده با گوگرد بسیار بهتر از کربن معمولی برای حذف فاز گازی جیوه عمل می کنند. در شرایط مطلوب، نرخ حذف بالاتر از 90 درصد با تزریق این کربن های فعال به صورت شیمیایی اشباع شده می تواند به دست آید. با این حال، این نرخ به صورت قابل توجهی بسته به کیفیت زغال سنگ و دمای جریان گاز کاهش می یابد و تولید کربن فعال اشباع شده به مواد خام سمی مثل گاز H2S نیاز دارد. مهم تر از این، تزریق کربن های فعال اشباع شده مقدار کربن در خاکستر را افزایش می دهد و بنابراین امکان استفاده از آن در مواد خام برای بتن را از بین می برد.
نتایج و بحث
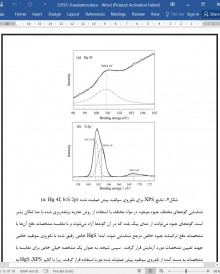
تعیین مشخصات جاذب. مساحت سطح ویژه عامل ZnS 25.3 متر مکعب بر گرم بود. نمونه های ZnS آماده شده مساحت سطح ویژه متفاوت به ترتیب 64.6، 105.9 و 196.1 متر مکعب بر گرم نشان دادند. این نشان می دهد که مساحت سطح ویژه روی سولفید می تواند به سادگی با تنظیم شرایط آماده سازی در طی فرایندهای رسوب گیری از فاز مایع کنترل شود. الگوی XRD نانوروی سولفید با بیشترین سطح ویژه 196.1 مترمربع بر گرم در شکل S2 نشان داده شده است. پیک های افتراقی مختلف به ترتیب در مقادیر 2θ مربوط به صفحات افتراق (111)، (220) و (311) است. پیک ها کاملا شبکه مکعبی روی در روی سولفید را نشان می دهند. همان طور که پیک های عریض روی الگوی XRD می تواند به اثرات ذرات کوچک نسبت داده شود، سه پیک عریض روی الگوی XRD نانو روی سولفید نشان می دهد که اندازه کریستال های روی سولفید در حد نانومتر است. میانیگن قطر نانوکریستال های روی سولفید با استفاده از معادله دبی-شرر با صفحه (111) در الگوی XRD محاسبه شد. نتایج نشان می دهد که قطر میانگین نانوکریستال ZnS حدود 6 نانومتر بود که به 4.5 نانومتر به دست آمده از تصاویر TEM نشان داده شده در شکل S3 نزدیک است. شکل S3 همچنین نشان می دهد که نانوکریستال های ZnS بسیار پراکنده شده اند.
ABSTRACT
The surface area of zinc sulfide (ZnS) was successfully enlarged using nanostructure particles synthesized by a liquid-phase precipitation method. The ZnS with the highest surface area (named Nano-ZnS) of 196.1 m2 ·g−1 was then used to remove gas-phase elemental mercury (Hg0 ) from simulated coal combustion fuel gas at relatively high temperatures (140 to 260 °C). The Nano-ZnS exhibited far greater Hg0 adsorption capacity than the conventional bulk ZnS sorbent due to the abundance of surface sulfur sites, which have a high binding affinity for Hg0 . Hg0 was first physically adsorbed on the sorbent surface and then reacted with the adjacent surface sulfur to form the most stable mercury compound, HgS, which was confirmed by X-ray photoelectron spectroscopy analysis and a temperature-programmed desorption test. At the optimal temperature of 180 °C, the equilibrium Hg0 adsorption capacity of the Nano-ZnS (inlet Hg0 concentration of 65.0 μg·m−3 ) was greater than 497.84 μg·g−1 . Compared with several commercial activated carbons used exclusively for gas-phase mercury removal, the Nano-ZnS was superior in both Hg0 adsorption capacity and adsorption rate. With this excellent Hg0 removal performance, noncarbon Nano-ZnS may prove to be an advantageous alternative to activated carbon for Hg0 removal in power plants equipped with particulate matter control devices, while also offering a means of reusing fly ash as a valuable resource, for example as a concrete additive.
INTRODUCTION
The constantly updated air pollutants emission inventory confirms that coal combustion continues to be a major source of emissions, responsible for about 475 tons of mercury emissions annually.1 Because of the extreme toxicity and bioaccumulation of methyl mercury transformed from emitted mercury,2 China and the United States adopted national mercury standards to limit mercury emissions from coal-fired power plants by December 2011.3,4 Elemental mercury (Hg0 ) is highly volatile and has a long lifespan in the atmosphere, thus making it a global environmental pollutant. As of March 2016, 128 nations have signed the Minamata Convention on Mercury to protect human health and the environment from the adverse effects of mercury from anthropogenic sources such as coal combustion. Various technologies, including activated carbon (AC) injection, have been developed to control mercury emissions from coal combustion to meet the requirements of global and regional mercury regulations.
Activated carbon injection is the maximum achievable control technology for mercury capture from coal-fired power plants.2 Due to the limited mercury capture capacity of raw activated carbons,5 chemical emendations including sulfur,6 chlorine,7 and bromine8 impregnation are currently being developed to enhance the mercury adsorption capacities of the activated carbons that are injected upstream of particulate matter control devices, which are either electrostatic precipitators or fabric filters. For example, sulfur-impregnated carbons perform much better than untreated carbon for gas-phase mercury removal.9 Under optimal conditions, removal rates greater than 90% can be attained with injections of these chemically impregnated activated carbons.8 However, the rates drop significantly depending on the coal quality and flue gas temperature,2,10 and production of the impregnated activated carbons requires toxic raw materials such as H2S gas.11 More importantly, injection of the impregnated activated carbons increases the carbon content of fly ash, thus preventing its reuse as a raw material for concrete.12 Most coal fly ash wastes are dumped in landfills rather than being reused for beneficial purposes,13 and evaluations of the stability of mercury in the landfill or aqueous environment have shown that carbon materials facilitate mercury methylation.14,15 M
RESULTS AND DISCUSSION
Characterization of Sorbents. The BET specific surface area of the ZnS agent was 28.3 m2 ·g−1 . The prepared ZnS samples exhibited different specific surface areas of 64.6 m2 ·g−1 , 105.9 m2 ·g−1 , and 196.1 m2 ·g−1 , respectively. This indicates that the specific surface area of ZnS can be easily controlled by adjusting the preparation conditions during the liquid-phase precipitation processes. The XRD pattern of the Nano-ZnS with the largest surface area of 196.1 m2 ·g−1 is shown in Figure S2. Various diffraction peaks at different 2θ values correspond to the (111), (220), and (311) diffraction planes, respectively. The peaks were perfectly indexed to the cubic zinc blende phase of ZnS. As broad diffraction peaks on the XRD pattern can be attributed to characteristic small particle effects,30 the typical broadening of the three diffraction peaks on the XRD pattern of the Nano-ZnS implies that the size of the ZnS crystals was in the nanometer range. The mean diameter of the ZnS nanocrystals was calculated using the Debye−Scherrer Equation31 with (111) reflection in the XRD pattern. The results show that the mean diameter of the ZnS nanocrystal was about 6 nm, which is close to the 4.5 nm measurement obtained from the TEM image shown in Figure S3. Figure S3 also shows that the ZnS nanocrystals were highly dispersed.
چکیده
مقدمه
بخش تجربی
نتایج و بحث
منابع
ABSTRACT
INTRODUCTION
EXPERIMENTAL SECTION
RESULTS AND DISCUSSION
REFERENCES
- اصل مقاله انگلیسی با فرمت ورد (word) با قابلیت ویرایش
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه