دانلود مقاله رمدسیویر برای درمان کووید-19
چکیده
پس زمینه گرچه چندین عامل درمانی برای درمان بیماری کورونا ویروس 2019 (Covid-19) مورد ارزیابی قرارگرفته است، اما هیچ یک از این عوامل موثر نبودهاند.
روشها ما یک کارآزمایی دو سو کور، تصادفی، کنترلشده با دارونمای درون وریدی مربوط به رمدسیویر را در بزرگسالان بستریشده مبتلا به Covid-19 با شواهدی از درگیری دستگاه تنفسی تحتانی، انجام دادیم. بيماران بهطور تصادفی تعیین شدند كه يك بار رمدسیویر (مقدار (دوز) اولیه 200 میلیگرم در روز اول و به دنبال آن 100 میلیگرم در روز تا حداکثر 9 روز دیگر) يا دارونما تا 10 روز دریافت کنند. پیامد اولیه، زمان بهبودی بود که با ترخیص از بیمارستان یا بستری شدن برای کنترل عفونت، تعریف شد.
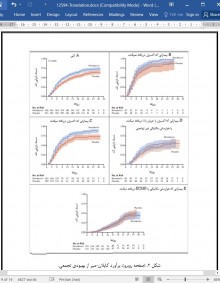
نتایج درکل 1063 بیمار به صورت تصادفی انتخاب شدند. هیئت نظارت بر داده ها و ایمنی، بر اساس یافتههای حاصل از تجزیه و تحلیل که مدت زمان کوتاهتر را برای بهبود در گروه رمدسیویر نشان میدهد، کورسازی نکردن (unblinding) اولیه را توصیه میکند. نتایج اولیه ی 1059 بیمار (مقرر شد که 538 نفر رمدسیویر و 521 دارونما دریافت کنند) همراه با دادههای موجود پس از تصادفیسازی نشان داد افرادی که رمدسیویر دریافت کردهاند دارای مدت زمان بهبودی 11 روز بودند (بازه اطمینان 95٪ [CI] ، 9 تا 12)، در مقایسه با 15 روز (بازه اطمینان95%، 13 تا 19) در افرادی که دارونما دریافت کرده بودند (نسبت سرعت برای بهبودی، 32/1؛ بازه اطمینان95٪ ، 1.12 تا 1.55؛ P <0.001). برآورد کاپلان–میر میزان مرگ در طی 14 روز 7.1% با رمدسیویر و 11.9% با دارونما بود (نسبت خطر مرگ، 70/0، بازه اطمینان 95٪، 47/0 تا 04/0). برای 114 مورد از 541 بیمار در گروه رمدسیویر که تحت تصادفیسازی قرار گرفتند (1/21٪) و 141 بیمار از 522 بیمار در گروه دارونما که تحت آمایش تصادفیسازی قرار گرفتند، پیامدهای نامطلوب رخ داد.
نتیجهگیری رمدسیویر در كوتاه كردن زمان بهبودی در بزرگسالان بستری شده مبتلا به کووید-19 و شواهدی ازعفونت دستگاه تنفسی تحتانی، نسبت به دارونما بهتر بود. (تأمین مالی شده توسط موسسه ملی آلرژی و بیماریهای واگیردار ایالات متحده آمریکا و سایرین؛ شمارهACCT-1 ClinicalTrials.gov ،NCT04280705.)
کرونا ویروس جدید، کروناویروس سندرم حاد تنفسی ۲ (SARS-CoV-2) ، برای اولین بار در دسامبر سال 2019 به عنوان علت بیماری تنفسی منتصب به بیماری کروناویروس 2019 یا Covid-19 شناخته شد. چندین عامل درمانی برای درمان Covid-19 مورد ارزیابی قرار گرفته است، اما هنوز هیچ یک از آنها موثر نبوده اند. رمدسیویر (GS-5734)، مهارکننده ویروسی وابسته به RNA است، RNA پلیمراز با فعالیت مهاری در برابر SARSCoV و سندرم تنفسی خاورمیانه (MERS-CoV)، در ابتدا به دلیل توانایی آن در مهار SARS-CoV-2 در شرایط آزمایشگاهی، به عنوان یک کاندید درمانی امیدوارکننده برایCovid-19 شناخته شد. علاوه بر این، در مطالعات پریماتهای (نخستیسانان) غیرانسانی، رمدسیویر 12 ساعت پس از تلقیح با MERS-CoVشروع به کاهش سطح ویروس ریه و آسیب ریه کرد.
برای ارزیابی اثربخشی بالینی و ایمنی عوامل درمانی تحقیقاتی فرضی در میان بزرگسالان بستری شده مبتلا به Covid- 19 که توسط آزمایشگاه تایید شدند، ما یک پلتفرم تطبیقپذیر برای انجام سریع آزمایشات فاز 3، تصادفی، دو سو کور و کنترل شده با دارونما طراحی کردیم. ما در اینجا نتایج اولیه مرحله اول کارآزمایی درمانی Covid-19تطبیقپذیر (ACTT-1) را شرح میدهیم، که در آن درمان با رمدسیویر را در مقایسه با دارونما ارزیابی کردیم.
بحث
نتایج مقدماتی این آزمایش پیشنهاد میکند که یک دوره 10 روزه رمدسیویر در درمان بیماران بستری شده مبتلا به کووید-19، بهتر از دارونما عمل میکند. این مزیت در تعداد روزهای مورد نیاز برای بهبودی دیده شد (میانگین 11 روز در مقایسه با 15 روز، نسبت نرخ بهبودی، 32/1 (95% CI)، 12/1 به 55/1) و نیز در بهبودی مطابق با امتیاز مقیاس ترتیبی در روز 15 (نسبت احتمالات، 50/1; 95% CI، 18/1 تا 91/1). گرچه آزمایش درحال انجام بود، هیئت نظارت بر دادهها و ایمنی توصیه کرد که نتایج برای اعضای تیم کارآزمایی NIAID آشکار و متعاقبا تصمیم گرفتند که نتایج عمومی شود. با توجه به قدرت نتایج رمدسیویر، تصور شد که این یافتهها برای مراقبت از بیمارانی که هنوز در آزمایش شرکت میکنند و نیز افراد خارج از آزمایش که ممکن است از درمان با رمدسیویر بهرهمند شوند، اهمیتی فوری دارد.
این مزیت در بیماران دارای امتیاز ترتیبی 5 (نیازمند اکسیژن) واضح تر بود، یافتهای که احتمالا بهدلیل بزرگتر بودن اندازه نمونه در این دسته است (از آنجا که آزمایش اثر متقابل تیمار با امتیاز شروع بر روی مقیاس ترتیبی، چشمگیر نبود). فواصل اطمینان امتیازهای ترتیبی نقطه شروع با مقدار 4 (عدم دریافت اکسیژن)، 6 (دریافت اکسیژن با جریان بالا) و 7 (دریافت ECMO یا هوارسانی مکانیکی) گسترده هستند. ما تصور میکنیم که زمان بهبودی میانگین برای بیماران در دسته 7 قابل پیشبینی نیست، که پیشنهاد میدهد مدت زمان پیگیری ممکن است کوتاه تر از آن باشد که بتوان این زیرگروه را ارزیابی کرد. پس از اینکه کل گروه، 28 روز پیگیری را کامل کردهاند و ممکن است بینش عمیقتری در درمان این زیرگروه حیاتی فراهم شود، تحلیلهای دیگری از نتایج مانند زمان بهبود یک یا دو نقطه بر روی میزان مقیاس ترتیبی انجام خواهد شد. یافتههای ما نیاز به تشخیص موارد کووید-19 و شروع درمان ضد ویروسی قبل از پیشرفت بیماری ریوی و نیاز به هوارسانی مکانیکی را برجسته میکند.
ABSTRACT
BACKGROUND Although several therapeutic agents have been evaluated for the treatment of coronavirus disease 2019 (Covid-19), none have yet been shown to be efficacious.
METHODS We conducted a double-blind, randomized, placebo-controlled trial of intravenous remdesivir in adults hospitalized with Covid-19 with evidence of lower respiratory tract involvement. Patients were randomly assigned to receive either remdesivir (200 mg loading dose on day 1, followed by 100 mg daily for up to 9 additional days) or placebo for up to 10 days. The primary outcome was the time to recovery, defined by either discharge from the hospital or hospitalization for infectioncontrol purposes only.
RESULTS A total of 1063 patients underwent randomization. The data and safety monitoring board recommended early unblinding of the results on the basis of findings from an analysis that showed shortened time to recovery in the remdesivir group. Preliminary results from the 1059 patients (538 assigned to remdesivir and 521 to placebo) with data available after randomization indicated that those who received remdesivir had a median recovery time of 11 days (95% confidence interval [CI], 9 to 12), as compared with 15 days (95% CI, 13 to 19) in those who received placebo (rate ratio for recovery, 1.32; 95% CI, 1.12 to 1.55; P<0.001). The KaplanMeier estimates of mortality by 14 days were 7.1% with remdesivir and 11.9% with placebo (hazard ratio for death, 0.70; 95% CI, 0.47 to 1.04). Serious adverse events were reported for 114 of the 541 patients in the remdesivir group who underwent randomization (21.1%) and 141 of the 522 patients in the placebo group who underwent randomization (27.0%).
CONCLUSIONS Remdesivir was superior to placebo in shortening the time to recovery in adults hospitalized with Covid-19 and evidence of lower respiratory tract infection. (Funded by the National Institute of Allergy and Infectious Diseases and others; ACCT-1 ClinicalTrials.gov number, NCT04280705.)
A novel coronavirus, severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), was first identified in December 2019 as the cause of a respiratory illness designated coronavirus disease 2019, or Covid-19.1 Several therapeutic agents have been evaluated for the treatment of Covid-19, but none have yet been shown to be efficacious.2,3 Remdesivir (GS-5734), an inhibitor of the viral RNA-dependent, RNA polymerase with inhibitory activity against SARSCoV and the Middle East respiratory syndrome (MERS-CoV),4-7 was identified early as a promising therapeutic candidate for Covid-19 because of its ability to inhibit SARS-CoV-2 in vitro.8 In addition, in nonhuman primate studies, remdesivir initiated 12 hours after inoculation with MERS-CoV9,10 reduced lung virus levels and lung damage.
To evaluate the clinical efficacy and safety of putative investigational therapeutic agents among hospitalized adults with laboratory-confirmed Covid-19, we designed an adaptive platform to rapidly conduct a series of phase 3, randomized, double-blind, placebo-controlled trials. Here, we describe the preliminary results of the first stage of the Adaptive Covid-19 Treatment Trial (ACTT-1), in which we evaluated treatment with remdesivir as compared with placebo.
Discussion
Preliminary results of this trial suggest that a 10- day course of remdesivir was superior to placebo in the treatment of hospitalized patients with Covid-19. This benefit was seen in the number of days to recovery (median, 11 days, as compared with 15; rate ratio for recovery, 1.32 [95% CI, 1.12 to 1.55]) and in recovery according to the ordinal scale score at day 15 (odds ratio, 1.50; 95% CI, 1.18 to 1.91). Even though the trial was ongoing, the data and safety monitoring board made the recommendation to unblind the results to the trial team members from the NIAID, who subsequently decided to make the results public. Given the strength of the results about remdesivir, these findings were deemed to be of immediate importance for the care of patients still participating in the trial as well as for those outside the trial who might benefit from treatment with remdesivir.
The benefit was most apparent in patients with a baseline ordinal score of 5 (requiring oxygen), a finding most likely due to the larger sample size in this category (since the interaction test of treatment by baseline score on the ordinal scale was not significant). Confidence intervals for baseline ordinal scores of 4 (not receiving oxygen), 6 (receiving high-flow oxygen), and 7 (receiving ECMO or mechanical ventilation) are wide. We note that the median recovery time for patients in category 7 could not be estimated, which suggests that the follow-up time may have been too short to evaluate this subgroup. Additional analyses of outcomes such as the time to a one- or two-point improvement on the ordinal scale score will be conducted after the full cohort has completed 28 days of followup and may provide additional insight into the treatment of this critical subgroup. Our findings highlight the need to identify Covid-19 cases and start antiviral treatment before the pulmonary disease progresses to require mechanical ventilation.
چکیده
پس زمینه
روشها
نتایج
نتیجهگیری
روشها
طرح
روندها
تحلیل آماری
نتایج
بیماران
نتایج اولیه
نتایج کلیدی ثانویه
بحث
منابع
ABSTRACT
BACKGROUND
METHODS
RESULTS
CONCLUSIONS
Design
Procedures
Statistical Analysis
Results
Patients
Primary Outcome
Key Secondary Outcome
Safety Outcomes
Discussion
References
- اصل مقاله انگلیسی با فرمت ورد (word) با قابلیت ویرایش
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه