دانلود مقاله خواص ترمودینامیکی محلول های جامد در سیستم Ag2 S-Ag2 Se
چکیده
داده های تجربی را روی نمودار فازی سیستم Ag2 S-Ag2 Se خلاصه کردیم. در این سیستم، توابع استاندارد ترمودینامیکی چهار محلول جامد با استفاده از مدل محلول های منظم و زیرمنظم: مجموعه محلول جامد محدود شده fcc یعنی y-Ag2S-Ag2S1_xSex (x<0.3, 867<T< 1110K) و سری کامل محلول جامدbcc همراه-Ag2S-Ag2Se β ، محلول جامد تک شیبی (a) از Ag2S تا Ag2S0.4Se0.6 ، و محلول جامد قائم الزاویه (راست گوشه) (a) از Ag2S0.3Se0.7 تا Ag2Seمحاسبه شد. Gmix و Smix با استفاده از مدل زیرمنظم محلول نامتقارن در منطقه Ag2S0.4Se0.6-Ag2S0.3Se0.7 ارزیابی شدند. داده های ترمودینامیکی را می توان برای مدل سازی سیستم های طبیعی پیچیده و در مسائل مواد نیمه هادی استفاده کرد.
1. مقدمه
کالکوژنیدها نقره ایی(Ag2Se, Ag2S, Ag2(S,Se)) با خواص منحصر به فرد: هدایت پایین حرارتی شبکه، وجود انتقال فازی و تبدیل فاز ساختاری [1] مشخص می شوند. Ag2S و Ag2 Se متعلق به گروه نیمه هادی ها هستند. Ag4SSe متعلق به گروه نیمه هادی n-type است. این ترکیبات می توانند برای تنوع اهداف مختلف مورد استفاده قرار گیرند. برخی از این موارد عبارتند از کاربرد در ساخت ژنراتورهای ترموالکتریکی (گرمابرقی)، حسگرهای Hall ، اَبَرشبکه ها [2،3].
محلول جامد احتمالی بین Ag2S و Ag2Se برای مدت زمان طولانی مورد بحث قرار گرفته است [4-7]. سه ماده معدنی نقره ایی با گوگرد و سلنیوم در طبیعت وجود دارد: آکانتیت (a-Ag2S)، ناومنیت (a-Ag2Se) و آگولی لیاریت (a-Ag4SeS) [http://www.mindat.org]. داده های مربوط به ترکیب شیمیایی آکانتیت، ناخالصی های سلنیوم بالا را نشان می دهد ، ناومنیت حاوی ناخالصی های قابل توجهی از گوگرد است و انحرافات گوگرد و سلنیوم که مربوط به استوکیومتری(عنصرسنجی) Ag4SSe هستند نوعی از آگولی لیاریت [4-7] می باشند. Petruk و همکاران [5] ارتباطاتی بین آکانتیت، آگولی لیارت، و ناومنیت را مورد بررسی قرار دادند و محدودیت های ترکیبی این مواد معدنی را یافت کردند: Ag2S-Ag2S0.85Se0.15 ، Ag4S0.95Se1.05-Ag4S1.10Se0.90 و Ag2S0.12Se0.88-Ag2Se. داده های تجربی موجود برای سیستم Ag2S-Ag2Se نشان دهنده دو محلول جامد در دمای محیط است (7-9(.Seryotkin و همکاران اخیرا انتقال مرفوتروپیک و جایگزینی هم شکلی سولفور سلنیوم در مجموعه Ag3Au(Se,S)2 را نشان داده اند (10).
5. نتیجه گیری
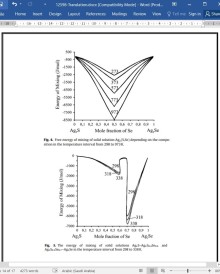
چهار محلول جامد: یک محلول جامد fcc ،y-Ag2S-Ag2S1_xSex (x<0.3, 867<T< 1110K) ، محلول جامد bcc پیوسته Ag2(S,Se) ، تک شیب Ag2S-Ag2S0.4Se0.6 و راست گوشه Ag2S0.3Se0.y-Ag2Se با شکاف حلالیت در Ag2S0.4Se0.6-Ag2S0.3Se0.7 با تعمیم داده های منتشر شده روی نمودار فازی سیستم Ag2S-Ag2Se شناسایی شدند. تخمین توابع استاندارد ترمودینامیکی هر محلول جامد در 0.1 مول کسر XSe انجام شد. توابع ترمودینامیکی مخلوط سازی: Gmix و Smix برای محدوده ای از ترکیبات Ag2S0.4Se0.6-Ag2S0.3Se0.7 محاسبه شد. داده های ترمودینامیکی را می توان برای مسائل مواد نیمه هادی و همچنین برای مدلسازی سیستم های پیچیده طبیعی اعمال کرد.
Abstract
We have summarized experimental data on the phase diagram of the system Ag2S–Ag2Se. Standard thermodynamic functions of four solid solutions in this system have been calculated using the model of regular and subregular solutions: a restricted fcc solid solution γ-Ag2S-Ag2S1−xSex (x < 0.3, 867 < T < 1110 K) and complete bcc solid solution series along β-Ag2S–Ag2Se, monoclinic solid solution (α) from Ag2S to Ag2S0.4Se0.6, and orthorhombic solid solution (α) from Ag2S0.3Se0.7 to the Ag2Se. Gmix and Smix have been evaluated using the subregular model for asymmetric solution for the region Ag2S0.4Se0.6–Ag2S0.3Se0.7. The thermodynamic data can be used for modeling in complex natural systems and in matters of semiconductor materials.
1. Introduction
The silver chalcogenides (Ag2Se, Ag2S, Ag2(S,Se)) are characterized by unique properties: low lattice thermal conductivity, presence of phase transitions and structural phase transformations [1]. Ag2S and Ag2Se belong to the group of semiconductors. Ag4SSe belongs to the group of n-type semiconductors. These compounds can be used for a variety of different purposes. Some of these include the application in construction of thermoelectrical generators, the Hall sensors, superlattices [2,3].
The possible solid solutions between Ag2S and Ag2Se have been debated for a long time [4–7]. In nature, there occur three minerals of silver with sulfur and selenium: acanthite (α-Ag2S), naumannite (α-Ag2Se) and aguilarite (α-Ag4SeS) [http://www.mindat.org]. The data on the chemical composition of acanthite indicate high selenium impurities, naumannite contains considerable impurities of sulfur, and deviations of sulfur and selenium in relation to Ag4SSe stoichiometry are typical of aguilarite [4–7]. Petruk et al. [5] investigated the relationships between acanthite, aguilarite and naumannite and suggested the compositional limits for these minerals: Ag2S–Ag2S0.85Se0.15, Ag4S0.95Se1.05–Ag4S1.10Se0.90 and Ag2S0.12Se0.88–Ag2Se. The available experimental data for the system Ag2S–Ag2Se indicate the presence of two solid solutions at ambient temperatures [7–9]. Sulfur-selenium isomorphous substitution and morphotropic transition in the Ag3Au(Se,S)2 series have been revealed recently by Seryotkin et al. [10].
5. Conclusions
Four solid solutions: a restricted fcc solid solution - Ag2S-Ag2S1−xSex (x < 0.3, 867 < T< 1110K), continuous bcc solid solution Ag2(S,Se), monoclinic Ag2S-Ag2S0.4Se0.6 and orthorhombic Ag2S0.3Se0.7-Ag2Se with a miscibility gap in the Ag2S0.4Se0.6–Ag2S0.3Se0.7 were identified by generalizing the published data on the phase diagram of the system Ag2S–Ag2Se. The estimation of the standard thermodynamic functions of each solid solution in 0.1 mole fraction xSe was performed. The thermodynamic functions of mixing: Gmix and Smix were calculated for a range of compositions Ag2S0.4Se0.6–Ag2S0.3Se0.7. Thermodynamic data can be applied to matters of semiconductor material, as well as for the modeling complex natural systems.
چکیده
1. مقدمه
2. اطلاعات تجربی
3. توصیف مدل
3.1 روش بررسی ارزیابی خواص استاندارد ترمودینامیکی محلول جامد Ag2(S,Se) با استفاده از مدل محلول زیرمنظم (برای محلول متقارن)
3.2 مدل نامتقارن برای محلول های جامد Ag2(S,Se)
4. نتایج و شرح مطلب
5. نتیجه گیری
منابع
ABSTRACT
1. Introduction
2. Experimental information
3. Model description
3.1. Methodology for evaluation of the standard thermodynamic properties of the solid solution Ag2(S,Se) by the subregular solution model (for symmetric solution)
3.2. An asymmetric model for solid solutions Ag2(S,Se)
4. Results and discussion
5. Conclusions
References
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه