دانلود مقاله آماده سازی داربست عروقی PU/Fibrin با خواص بیومکانیکی خوب و ارزیابی عملکرد آن
چکیده
هدف: توسعه رگهای خونی با مهندسی بافت منبع جدیدی از اهدا کنندگان برای پیوند عروق کرونر و پیوند رگهای خونی محیطی را فراهم می کند. الیاف فیبرین از قابلیت زیست سازگاری خوبی برخوردار بوده و یک داربست عروقی مهندسی بافت شده ایده آل محسوب می شود، اما خاصیت مکانیکی آن نیاز به بهبود دارد.
روش ها: به منظور آماده سازی داربست های عروقی PU / فیبرین با استفاده از فناوری الکتروریسی به منظور افزایش خواص مکانیکی داربست فیبرین اقدام به ترکیب پلی یورتان (PU) و فیبرین نمودیم. ما اقدام به بررسی ویژگی های مورفولوژیکی، مقاومت مکانیکی، آب دوستی، تخریب، سازگاری خونی و سلولی داربست های عروقی PU/fibrin (0:100)، PU/fibrin (5:95)، PU/fibrin (15:85) و PU/fibrin (25:75) نمودیم. بر اساس نتایج در شرایط آزمایشگاهی، PU/fibrin (15:85) برای پیوند داخل بدن برای ترمیم نقص عروقی انتخاب شد و تشکیل ماتریکس خارج سلولی، بازسازی عروق و پاسخ ایمنی مورد بررسی قرار گرفت.
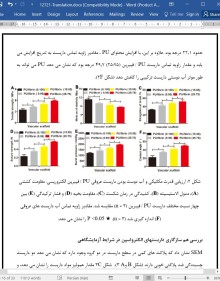
نتایج: نتایج نشان داد که قطر فیبر داربست PU / فیبرین (15:85) حدود 712 نانومتر بود. با افزایش محتوای PU، مقاومت مکانیکی داربست های کامپوزیتی افزایش می یابد، با این وجود، سرعت تخریب به تدریج کاهش پیدا می کند. داربست PU/fibrin آب دوستی و سازگاری خوبی با خون را نشان داد. داربست عروقی PU / فیبرین (15:85) می تواند باعث افزایش چسبندگی و تکثیر سلولهای استرومایی مزانشیمی (MSC) شود. نتایج تجربی کمّی RT-PCR نشان داد که بیان ژن های کلاژن، سوروایوین و ویمنتین در PU / فیبرین (15:85) بیشتر از PU / فیبرین (25:75) است. نتایج در داخل بدن نشان داد که خواص مکانیکی و انطباق پیوندهای PU / فیبرین می تواند نیازهای بالینی را برآورده کند و نسبت ترومبوز یا انسداد به طور قابل توجهی پایین تر بود. پیوند، پاسخ وازوموتوری قوی نشان داد و سلولهای عضله صاف، سلولهای اندوتلیال، و رسوب ECM عروق جدید با عروق قدیمی بعد از 3 ماه قابل مقایسه بود. در 3 ماه، میزان ماکروفاژها در پیوندهای PU / فیبرین به طور قابل توجهی پایین تر بود و ترشح سیتوکین های پیش التهاب و ضد التهاب کاهش یافت.
نتیجه گیری: داربست های عروقی PU/fibrin (15:85) پتانسیل زیادی برای استفاده به عنوان رگ های خونی مهندسی بافت با قطر کم داشتند.
مقدمه
بیماری های قلبی عروقی (CVD) همیشه سلامت جسمی و روحی انسان ها را در سراسر جهان تهدید کرده است. بر اساس نتایج گزارش تحقیقاتی سازمان بهداشت جهانی، میزان مرگ و میر ناشی از CVD به طور قابل توجهی بالاتر از انواع دیگر بیماری ها است. همزمان، تعداد مرگ ناشی از CVD حدود %30.8 از کل مرگ و میر بیماری ها در ایالات متحده را تشکیل می دهد و محققان پیش بینی می کنند که در 15 سال آینده تعداد CVD به 23.4 میلیون نفر برسد. تا به امروز، اکثر محققان پزشکی به طور کلی معتقدند که بهترین درمان برای CVD جدی، بازسازی عروق است. به طور مفصل، روشهای اصلی جراحی بر اساس شدت CVDs مداخله از راه پوست عروق کرونر یا پیوند عروق کرونر است. ضمناً، میزان بروز نقایص مادرزادی قلبی عروقی کودکان (CCD) در ایالات متحده 0.83، است، مانند نقص دیواره دهلیزی، نقص دیواره بطن و مجرای شریانی. اکثر اطفال مبتلا به CVD به دلیل CCD باید مکرراً با جراحی ترمیمی تحت درمان قرار گیرند. علاوه بر این، معاینه مجاری CVD ها و CCD ها معمولاً از وریدهای صافن خود بیمار ناشی می شوند. به دلیل اندازه کوچک، واریس (تورم رگ)، تغییرات آناتومیک، برداشت قبلی یا سایر ناهنجاری ها در پیوند اتولوگ، بنابراین کاربرد آن محدود است. بنابراین، ظهور پیوندهای عروقی مصنوعی یک روش عملی و موثر جدید برای درمان انواع مختلف عوارض شریانی، به ویژه برای بیماران جوان مناسب به ارمغان می آورد.
نتیجه گیری
در این مقاله، ما با موفقیت داربست عروقی PU / فیبرین را با استفاده از فناوری الکتروپینینگ آماده کردیم. نتایج تایید کرد که قطر فیبر داربست عروقی PU / فیبرین کوچکتر از داربست PU است. با افزایش محتوای PU، مقاومت مکانیکی داربست های عروقی PU / فیبرین به تدریج افزایش می یابد. با این حال، هنگامی که محتوای PU در داربست PU / فیبرین به %25 رسید، توانایی تکثیر سلولی به طور قابل توجهی تحت تأثیر قرار گرفت. بنابراین، داربست عروقی PU / فیبرین (15:85) قدرت مکانیکی متعادل ، سازگاری خون، تجزیه پذیری و سازگاری سلول را نشان داد. علاوه بر این، ما دریافتیم که عملکرد و قدرت مکانیکی PU / فیبرین شریان جدید (15:85) در 3 ماه پس از پیوند به عروق مادرزادی بسیار محصور بود. همزمان، میزان سلولهای SMC و EC و بیان ECM در پیوند عروقی PU / فیبرین (15:85) در 3 ماه به طور قابل توجهی بیشتر از پیوند عروقی PU بود، اما ماکروفاژها کمتر بودند. به طور کلی ، پیوندهای عروقی PU / فیبرین می تواند به عنوان یک داربست عروقی مهندسی بافت با قطر کوچک ایده آل استفاده شود، و این تحقیق پیشرفت در زمینه رگهای خونی مهندسی بافت را ارتقا می بخشد.
Abstract
Purpose: The development of tissue-engineered blood vessels provides a new source of donors for coronary artery bypass grafting and peripheral blood vessel transplantation. Fibrin fiber has good biocompatibility and is an ideal tissue engineering vascular scaffold, but its mechanical property needs improvement.
Methods: We mixed polyurethane (PU) and fibrin to prepare the PU/fibrin vascular scaffolds by using electrospinning technology in order to enhance the mechanical properties of fibrin scaffold. We investigated the morphological, mechanical strength, hydrophilicity, degradation, blood and cell compatibility of PU/fibrin (0:100), PU/fibrin (5:95), PU/fibrin (15:85) and PU/fibrin (25:75) vascular scaffolds. Based on the results in vitro, PU/fibrin (15:85) was selected for transplantation in vivo to repair vascular defects, and the extracellular matrix formation, vascular remodeling, and immune response were evaluated.
Results: The results indicated that the fiber diameter of the PU/fibrin (15:85) scaffold was about 712nm. With the increase of PU content, the mechanical strength of the composite scaffolds increased, however, the degradation rate decreased gradually. The PU/fibrin scaffold showed good hydrophilicity and hemocompatibility. PU/fibrin (15:85) vascular scaffold could promote the adhesion and proliferation of mesenchymal stromal cells (MSCs). Quantitative RT-PCR experimental results showed that the expression of collagen, survivin and vimentin genes in PU/fibrin (15:85) was higher than that in PU/fibrin (25:75). The results in vivo indicated the mechanical properties and compliance of PU/fibrin grafts could meet clinical requirements and the proportion of thrombosis or occlusion was significantly lower. The graft showed strong vasomotor response, and the smooth muscle cells, endothelial cells, and ECM deposition of the neoartery were comparable to that of native artery after 3 months. At 3 months, the amount of macrophages in PU/fibrin grafts was significantly lower, and the secretion of pro-inflammatory and anti-inflammatory cytokines decreased.
Conclusion: PU/fibrin (15:85) vascular scaffolds had great potential to be used as small-diameter tissue engineering blood vessels.
Introduction
Cardiovascular diseases (CVDs) have always threatened the physical and mental health of human beings worldwide. According to the results of the World Health Organization research report, the morbidity and mortality of CVDs are significantly higher than other types of diseases.1 At the same time, the number of deaths from CVDs accounts for about 30.8% of all diseases deaths in the United States, and the researchers predict that the number of CVDs will reach 23.4 million in the next 15 years.2,3 To date, the majority of medical researchers generally believe that the best treatment for serious CVDs is vascular reconstruction. In detail, the main surgical methods based on the severity of CVDs are percutaneous coronary intervention or coronary artery bypass grafting. Simultaneously, the incidence rate of pediatric congenital cardiovascular defects (CCDs) in the United States is 0.83%, such as atrial septal defect, ventricular septal defect and patent ductus arteriosus. Most pediatric patients with CVDs due to CCDs should be repeatedly treated with reconstructive surgery.4 Moreover, blood vessels in the bypass treatment of CVDs and CCDs usually come from patient’s own saphenous veins. Due to small size, varicosities, anatomic variation, previous harvesting, or other abnormalities in autologous transplantation, so its application is limited.5 Therefore, the emergence of artificial vascular grafts brings a new feasible and effective method for the treatment of various types of arterial complications, especially suitable for young patients.
Conclusion
In this article, we successfully prepared PU/fibrin vascular scaffold by electrospinning technology. The results con firmed that the fiber diameter of the PU/fibrin vascular scaf fold was smaller than that of the PU scaffold. With the increase of PU content, the mechanical strength of PU/fibrin vascular scaffolds increased gradually. However, when the content of PU in PU/fibrin scaffold reached 25%, the cell proliferation ability was significantly affected. Therefore, the PU/fibrin (15:85) vascular scaffold showed balanced mechanical strength, blood compatibility, degradability and cell compatibility. Moreover, we found that the function and mechanical strength of PU/fibrin (15:85) neoarteries was very closed to that of native arteries at 3 months after implantation. Concurrently, the cells amount of SMCs and ECs and ECM expression in PU/fibrin (15:85) vascular grafts at 3 months were significantly more than those of PU vas cular grafts, but the macrophages were fewer. Overall, PU/ fibrin vascular grafts could be used as an ideal small-diameter tissue engineering vascular scaffold, and this research would promote progress of tissue engineering blood vessels field.
چکیده
مقدمه
مواد و روش ها
مواد
آماده سازی داربست عروقی PU / Fibrin
داربست های PU / Fibrin مشاهده شده توسط SEM
ارزیابی خصوصیات مکانیکی
تست خواص کششی
مقاومت بخیه
مقاومت در برابر ترکیدگی
تشخیص زاویه تماس آب
تجزیه و تحلیل تعامل داربست- خون
آزمایش چسبندگی پلاکت داربست
تست همولیز
آزمایش انعقاد خون پویا
آزمایش آنتی ترومبین
بررسی تخریب داربستهای عروقی در شرایط آزمایشگاهی
تجزیه و تحلیل تعامل سلول - داربست
تست رنگ آمیزی سلول زنده
تکثیر MSC در داربست ها
بررسی بیان ژن توسط RT-PCR کمّی
ارزیابی عملکرد پیوندهای عروقی در داخل بدن
پیوند در روش درون تنی
ارزیابی عملکرد پیوندهای عروقی
تست بیومکانیکی پیوند در داخل بدن
رنگ آمیزی ایمونوفلورسانس
تحلیل بافت شناسی
تحلیل آماری
نتایج
مورفولوژی داربست فیبرین/ PU Electrospun
توصیف خصوصیات مکانیکی و آب دوستی
بررسی هم سازگاری داربستهای الکترواسپن در شرایط آزمایشگاهی
تخریب آزمایشگاهی داربست عروقی
رفتار تکثیر MSC ها و ژن ها
بیان عصاره داربست
گشودگی، عملکرد و خصوصیات مکانیکی پیوندهای عروقی در داخل بدن (درون تنی)
نفوذ سلولی و واکنش ایمنی پیوندهای عروقی در داخل بدن (درون تنی)
رسوب ECM در پیوند عروقی PU / فیبرین
بحث
نتیجه گیری
منابع
ABSTRACT
Introduction
Materials and Methods
Materials
PU/Fibrin Vascular Scaffold Preparation
Observed of PU/Fibrin Scaffolds by SEM
Evaluation of Mechanical Properties
Tensile Properties Test
Suture Strength
Burst Strength
Water Contact Angle Detection
Analysis of Blood-Scaffold Interaction
Experiment of Platelet Adhesion of the Scaffold
Hemolysis Test
Dynamic Coagulation Assa
Antithrombin Tria
Investigation on the Degradation of Vascular Scaffolds in vitr
Analysis of Cell-Scaffold Interactio
Live Cell Staining Tes
Proliferation of MSCs on Scaffolds
Investigation on the Gene Expression by Quantitative RT-PCR
Performance Evaluation of Vascular
Grafts in vivo
Graft Transplantation in vivo
Functionality Assessment of Vascular Grafts
Biomechanical Test of Grafts in vivo
Immunofluorescence Stainin
Histological Analysi
Statistical Analysi
Resul
Morphology of Electrospun PU/Fibrin Scaffo
Characterization of Mechanical Properties and Hydrophilicit
Investigation of Hemocompatibility of Electrospun Scaffolds in vitro
Degradation in vitro of Vascular Scaffolds
Proliferation Behavior of MSCs and Gene
Expression of Scaffolds Extract
The Patency, Functionality and Mechanical Properties of Vascular Grafts in vivo
Cell Infiltration and Immunoreaction of Vascular Grafts in vivo
ECM Deposition in PU/Fibrin Vascular Graft
Discussion
Conclusion
References
- اصل مقاله انگلیسی با فرمت ورد (word) با قابلیت ویرایش
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش، بدون آرم سایت ای ترجمه
- ترجمه فارسی مقاله با فرمت pdf، بدون آرم سایت ای ترجمه