دانلود مقاله نقش گلوتاتیون پراکسیدازها در هم ایستایی واکنش اکسایش-کاهش کلروپلاست در گیاه آرابیدوپسیس
چکیده
از جمله عوامل مهمی که در تنظیم تعادل واکنش اکسایش-کاهش کلروپلاست در پاسخ به تغییرات شدت نور نقشی اساسی ایفا می کنند عوامل اکساینده واسطه هستند و این کار را به وسیله فعالیت پراکسیداز وابسته به تیول در پروکسی ردوکسین سیستئین-2 انجام میدهند و برای انجام این عملکرد به تیوردوکسین ردوکتازوابسته به نیکوتین آمید آدنین دی نوکلئوتید فسفات نیاز دارند. علاوه بر این، کلروپلاست های گیاهی مجهز به گلوتاتیون پراکسیدازها ،پراکسیدازهایی تیول دار هستند که به تیوردوکسین ها متکی هستند .اگرچه عوامل اکساینده واسطه گلوتاتیون پراکسیدازها دارای یک مکانیزم واکنشی مشابه با پروکسی ردوکسین سیستئین-2هستند اما هنوز نقش آنها درهموستازی اکسایش-کاهش کلروپلاست زیاد مشخص نیست .به منظوربررسی این موضوع ، ما بروی گیاه آرابیدوپسیس تحقیق کرده ایم که دارای دو جهش گلوتاتیون پراکسید1، گلوتاتیون پراکسید7 بود و فاقد دو گلوتاتیون پراکسیداز 1 و 7 مستقر در کلروپلاست بود. علاوه بر این، برای تجزیه و تحلیل رابطه عملکردی گلوتاتیون پراکسیدازهای کلروپلاست با سیستم اکسیداسیون و کاهش پروکسی ردوکسین سیستئین-2- تیوردوکسین ردوکتازجهش های گلوتاتیون پراکسید1، گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2و گلوتاتیون پراکسید1گلوتاتیون پراکسید7-تیوردوکسین ردوکتازایجاد شدند.جهش گلوتاتیون پراکسید1،گلوتاتیون پراکسید7 فنوتیپ نوع وحشی را نشان می دهد که اثبات کننده این است که گلوتاتیون پراکسیدازهای کلروپلاست برای حداقل رشد گیاه تحت شرایط استاندارد ضروری هستن .با این حال،جهش- گلوتاتیون پراکسید1 گلوتاتیون پراکسید7- شپرون پروتئینی متصل غشایی2رشد کندتری نسبت به جهش شپرون پروتئینی متصل غشایی2 نشان داد .فقدان همزمان پروکسی ردوکسین سیستئین-2و گلوتاتیون پراکسیداز بر عملکرد محتوای کلروفیل و عملکرد فتوسیستم2تأثیر گذاشت و باعث تاخیر بیشتر در اکسیداسیون آنزیم در تاریکی شد.در مقابل جهش-گلوتاتیون پراکسید-1گلوتاتیون پراکسید7-تیوردوکسین ردوکتاز، با ترکیب کردن فقدان تیوردوکسین ردوکتازو گلوتاتیون پراکسیدازهای کلروپلاست مانند جهش تیوردوکسین ردوکتاز رفتار می کنند که نشان می دهد سهم گلوتاتیون پراکسیدازهادر هم ایستایی واکنش اکسایش-کاهش کلروپلاست مستقل از تیوردوکسین ردوکتازاست.سنجش های آزمایشگاهی به بررسی بیشتر این نظریه پرداختند و نشان دادند که فرایند کاهش توسط تیوردوکسین ردوکتاز اتفاق نمی افتد، بلکه کاهش به وسیله تیوردوکسین y2 رخ میدهد.بر اساس این نتایج، ما نقشی را برای گلوتاتیون پراکسیدازها در توالی اکسایش-کاهش کلروپلاست ارائه دادیم .
1-مقدمه
کلروپلاست ها،یعنی اندامک هایی که کار فتوسنتز را انجام می دهند،مجموعه ایی از واسطه های متابولیکی هستند که باعث افزایش رشد و نمو گیاهان میشوند. از آنجا که فتوسنتز شامل انتقال الکترون ها در حضور اکسیژن است، این فرآیند به طورحتمی محصولات جانبی گونه های فعال اکسیژن تولید می کند که شامل سوپراکسید، پراکسید هیدروژن، اکسیژن منفرد و رادیکال های هیدروکسیل هستند[1-3]. گونه های فعال اکسیژن،واکنش پذیری بالایی با لیپیدها،پروتئین ها و اسیدهای نوکلئیک دارند. از این رو، تجمع آنها ممکن است باعث آسیب به ساختار سلولی و در نهایت،مرگ سلولی شود[4] بجز این اثر مضر،گونه های فعال اکسیژن دارای یک عملکردسیگنالینگ(پیام رسانی)مهم هستند که برای رشد گیاه و پاسخ به محیط ضروری می باشد[3،5-7]بنابراین، کلروپلاست ها علاوه بر تولید واسطه های متابولیک، منبع مهمی از گونه های فعال اکسیژن در سلول های گیاهی فتوسنتزی هستند که سطوح آن ها زمانی که گیاهان تحت شرایط محیطی استرس زا قرار می گیرند، متفاوت است، از این رو این عملکرد سیگنال دهی سلولی مهم باعث سازگاری گیاه با محیط میشود [1،8].
رشد و نمو گیاه به عملکرد فتوسنتزی بستگی دارد که نیاز به یک تعادل دقیق بین تولید کلروپلاست در گونه های فعال اکسیژن و مهار آن دارد. این تعادل توسط آنتی اکسیدان های غیر آنزیمی مانند آکاروتنوئیدها، آسکوربات و گلوتاتیون[9]و آنتی اکسیدان های آنزیمی که شامل مجموعه ای از آنزیم هایی هستند که نشان دهنده ی فعالیت مهارشدن گونه های فعال اکسیژن هستند،حفظ می شود.در میان این آنزیم ها، کلروپلاست های گیاهی مجهز به سوپراکسید دیسموتاز هستند که تبدیل سوپراکسید به پراکسید هیدروژن را کاتالیز می کنند[10]. کاهش پراکسید هیدروژن توسط دو نوع پراکسیداز انجام می شود، اولی آسکوربات پراکسیداز که یک اندامک دارای دو ایزوفرم موضعی در استروما و تیلاکوئید است،و دیگری پراکسیدازهای تیول دار شامل پراکسیردوکسین ها و گلوتاتیون پراکسیدازها.خانواده ژن کد کننده پراکسیردوکسین در آرابیدوپسیس تالیانا از 10 ژن تشکیل شده است [15،16]بسته به مکانیسم واکنش و ساختار آنزیمی،پراکسیردوکسین های گیاهی به دو گروه طبقه بندی می شوند اول پراکسیردوکسین های سیستئین-1که حاوی یک سیستئین در محل فعال و دومی پراکسیردوکسین سیستئین2-که حاوی دو سیستئین، پراکسیداتیک ویک حل شونده، در محل فعال خود هستند [14،15].پراکسیردوکسین های سیستئین-2بیشتر به عنوان پراکسیردوکسین های سیستئین-2 غیر معمول گروه بندی می شوند که مونومر هستند، از این رو حاوی سیستئین های پراکسیداتیک و حل شونده در یک پلی پپتید منفرد هستند،و پراکسیردوکسین های سیستئین-2،آنزیم های همودیمر همراه با دو زیر واحد به صورت سر به دم مرتب شده اند که در آن سیستئین های پراکسیداتیک و حل شونده در زیر واحدهای مختلف قرار دارند [15،17]در سلول های گیاهی، کلروپلاست اندامکی است که دارای بالاترین مقدار پراکسیردوکسین های سیستئین-2 است، در مورد آرابیدوپسیس،کلروپلاست ها حاوی دو پراکسیردوکسین های سیستئین-2 معمولی تقریباً یکسان،A و B هستند که از فراوان ترین پروتئین ها در استروما [18] و پراکسیدوکسین IIE و پراکسیدوکسین Qغیر معمول هستند [15].
5- نتیجه گیری
در این مطالعه،از ترکیبی از رویکردهای ژنتیکی و بیوشیمیایی برای تعیین نقش کلروپلاست گلوتاتیون پراکسیدازها در شبکه پیچیده اکسایش-کاهش اندامک استفاده شد که در طرح نشان داده شده در شکل 8 خلاصه شده است مشکلات فنوتیپی شدیدی که در فقدان تیوردوکسین ردوکتاز]45.75- [و پروکسی ردوکسین سیستئین 2 رخ داد از نقش اصلی دوگانه اکسایش-کاهش تیوردوکسین ردوکتاز -پروکسی ردوکسین سیستئین 2s در تعیین وضعیت اکسایش-کاهش برای اهداف تنظیم شده اکسایش-کاهش حمایت می کند. با توجه به این مدل (شکل8) فرودوکسین , پذیرنده نهایی زنجیره انتقال الکترون فتوسنتزی است که ، معادل های کاهنده ای را برای تیوردوکسین ها ارائه می دهد و از طریق فرودوکسین-نیکوتین آمید آدنین دی نوکلئوتید فسفات ردوکتاز و نیکوتین آمید آدنین دی نوکلئوتید فسفات امکان کاهش اهداف حساس اکسایش-کاهش را در پاسخ به نور را برای تیوردوکسین ردوکتازفراهم میکند.مشکلات شدید فنوتیپی در آرابیدوپسیس جهش یافته به دلیل ترکیبی از فقدانهای تیوردوکسین ردوکتازو تیوردوکسین f ،[60] s و تیوردوکسین x ] 59[ است که با کاهش محتویات پروکسی ردوکسین سیستئین2 -]40[ سرکوب می شوند. و این امکان را ایجاد میکند تا ظرفیت کاهنده این تیوردوکسین ها با سیستم تیوردوکسین ردوکتاز -پروکسی ردوکسین سیستئین پیوند ایجادکند (شکل 8، مسیر سبزدر نور)، تیوردوکسین ردوکتاز باعث حفظ تعادل ردوکس پروکسی ردوکسین سیستئین 2 را میشود و در نتیجه از تخلیه الکترون ها از تیوردوکسین ها جلوگیری می کند (شکل 8، فلش سبز نقطه چین(.این موضوع برای تیوردوکسین های معمولی از انواع x، f و m نشان داده شده است، اما احتمالاً بر سایر تیوردوکسین ها تأثیر می گذارد. درشزایط تاریکی، پروکسی ردوکسین سیستئین 2 ها واسطه انتقال معادل های احیا کننده به پراکسید هیدروژن با مشارکت تیوردوکسین های اکسید کننده مانند ACHT1 [34]، ACHT4 [35] و تیوردوکسین L2 [32] هستند (شکل 8، مسیر قرمز( تیوردوکسینهای معمولی همچنین ممکن است به این مسیر اکسیداتیو کمک کنند همانطور که توسط سنجش های آزمایشگاهی نشان داده شده است که مشارکت تیوردوکسینs f و پروکسی ردوکسین سیستئین 2 را در اکسیداسیون فروکتوز-1،6-بیس فسفاتاز، در میان سایر پروتئین های تنظیم شده ردوکس نشان می دهند [32،41،42 [ . اگرچه در این کار تجزیه و تحلیل نشده است، اما به نظر می رسد پروکسی ردوکسین Q و پروکسی ردوکسین IIE غیر معمول، و همچنین در کلروپلاست های آرابیدوپسیس]15.16[ نقش جزئی در هموستاز ردوکس کلروپلاست دارند [41[ در حالی که پروکسی ردوکسین Q را می توان با تیوردوکسینs y [30] کاهش داد، نشان داده شد که پروکسی ردوکسین IIE توسط گلوتاردوکسین به جای تیوردوکسین ها بازسازی می شود [62،63[ علاوه بر این، تعامل تیوردوکسین IIE با پروتئین های 14-3-3 نشان می دهد که نقش این پروکسی ردوکسین در سیگنال دهی ردوکس با فعالیت پراکسیداز آن ارتباطی ندارد [62[.برخلاف پروکسی ردوکسین سیستئین 2، اثر گلوتاتیون پراکسیدازها مستقل از تیوردوکسین ردوکتاز است، همانطور که توسط فنوتیپ های مشابه جهش یافته های تیوردوکسین ردوکتاز و تیوردوکسین ردوکتاز گلوتاتیون پراکسید1، گلوتاتیون پراکسید7 پیشنهاد شده است (شکل 5A, C, D؛ شکل ( S1A-Cو ناتوانی تیوردوکسین ردوکتاز در کاهش گلوتاتیون پراکسیدازهای 1 و 7 (شکل 6A و (Bاز آنجایی که کارآمدترین احیاکننده گلوتاتیون پراکسیدازهای کلروپلاست تیوردوکسین y2 است (شکل 6C)همانطور که قبلا برای آنزیم صنوبر [22] گزارش شده بود، اثر گلوتاتیون پراکسیدازها بر عملکرد کلروپلاست احتمالاً از طریق این تیوردوکسین ها اعمال می شود. در این رابطه شایان ذکر است که برخلاف فنوتیپ های شدید جهش های تیوردوکسین ردوکتاز –نوع f1 وf2 و تیوردوکسین ردوکتازنوع x - [59] و جهش تیوردوکسین ردوکتاز نوع y1y2فنوتیپی مانند جهش تیوردوکسین ردوکتاز را نشان می دهد [31[ در مجموع، این نتایج نشان می دهد که تیوردوکسین y توسط تیوردوکسین ردوکتاز -پروکسی ردوکسین سیستئین 2کنترل نمی شود، بلکه توسط گلوتاتیون پراکسیدازها کنترل می شود (شکل 8، مسیر خاکستری)
Abstract
Oxidizing signals mediated by the thiol-dependent peroxidase activity of 2-Cys peroxiredoxins (PRXs) plays an essential role in fine-tuning chloroplast redox balance in response to changes in light intensity, a function that depends on NADPH-dependent thioredoxin reductase C (NTRC). In addition, plant chloroplasts are equipped with glutathione peroxidases (GPXs), thiol-dependent peroxidases that rely on thioredoxins (TRXs). Despite having a similar reaction mechanism than 2-Cys PRXs, the contribution of oxidizing signals mediated by GPXs to the chloroplast redox homeostasis remains poorly known. To address this issue, we have generated the Arabidopsis (Arabidopsis thaliana) double mutant gpx1gpx7, which is devoid of the two GPXs, 1 and 7, localized in the chloroplast. Furthermore, to analyze the functional relationship of chloroplast GPXs with the NTRC-2-Cys PRXs redox system, the 2cpab-gpx1gpx7 and ntrc-gpx1gpx7 mutants were generated. The gpx1gpx7 mutant displayed wild type-like phenotype indicating that chloroplast GPXs are dispensable for plant growth at least under standard conditions. However, the 2cpab-gpx1gpx7 showed more retarded growth than the 2cpab mutant. The simultaneous lack of 2-Cys PRXs and GPXs affected PSII performance and caused higher delay of enzyme oxidation in the dark. In contrast, the ntrc-gpx1gpx7 mutant combining the lack of NTRC and chloroplast GPXs behaved like the ntrc mutant indicating that the contribution of GPXs to chloroplast redox homeostasis is independent of NTRC. Further supporting this notion, in vitro assays showed that GPXs are not reduced by NTRC but by TRX y2. Based on these results, we propose a role for GPXs in the chloroplast redox hierarchy.
1. Introduction
Chloroplasts, the organelles that perform photosynthesis, are the factories of metabolic intermediates that support plant growth and development. However, because photosynthesis involves the transport of electrons in the presence of oxygen, it is a process that inevitably generates as by-products reactive oxygen species (ROS), which include superoxide, hydrogen peroxide, singlet oxygen, and hydroxyl radicals [1–3]. ROS have high reactivity with lipids, proteins, and nucleic acids; hence, their accumulation may cause damage to cell structures and, eventually, cell death [4]. In addition to this harmful effect, ROS have an important signaling function, which is essential for plant development and response to the environment [3,5–7]. Therefore, besides producing metabolic intermediates, chloroplasts are as well an important source of ROS in photosynthetic plant cells, the levels of which vary when plants undergo stressful environmental conditions, hence having an important signaling function in plant acclimation to the environment [1,8].
Plant growth and development depend on photosynthetic performance, which needs a strict balance between chloroplast ROS production and scavenging. This balance is maintained by non-enzymatic antioxidants such as carotenoids, ascorbate, and glutathione [9], and enzymatic antioxidants including a set of enzymes that show ROS scavenging activity. Among these enzymes, plant chloroplasts are equipped with superoxide dismutases that catalyze the conversion of superoxide to hydrogen peroxide [10]. The reduction of hydrogen peroxide is performed by two types of peroxidases, ascorbate peroxidases (APXs), of which the organelle harbors two isoforms localized at the stroma and the thylakoid, and thiol-dependent peroxidases (TPXs) including peroxiredoxins (PRXs) and glutathione peroxidases (GPXs) [11–14]. The gene family encoding PRXs in Arabidopsis thaliana is composed of 10 genes [15,16]. Depending on the reaction mechanism and enzyme structure, plant PRXs are classified into 1-Cys PRXs, which contain a single cysteine at the active site, and 2-Cys PRXs, containing two cysteine residues, peroxidatic and resolving, at their active site [14, 15]. 2-Cys PRXs are further grouped as atypical 2-Cys PRXs, which are monomeric, hence containing the peroxidatic and resolving cysteines in a single polypeptide, and typical 2-Cys PRXs, homodimeric enzymes with the two subunits arranged in a head-to-tail conformation in which the peroxidatic and resolving cysteines are in different subunits [15,17]. In plant cells, the chloroplast is the organelle with the highest contents of 2-Cys PRXs; in the case of Arabidopsis, chloroplasts contain two almost identical typical 2-Cys PRXs, A and B, which are among the most abundant proteins in the stroma [18], and atypical PRX IIE and PRX Q [15].
5. Conclusion
In this study, we have used a combination of genetic and biochemical approaches to determine the role of chloroplast GPXs into the complex redox network of the organelle, which is summarized in the scheme shown in Fig. 8. The severe phenotypic consequences of the lack of NTRC [45,57] and 2-Cys PRXs [46,58] support the central role of the NTRC-2-Cys PRXs redox couple in determining the redox state of redox-regulated targets. According to this model (Fig. 8), FDX, the final acceptor of the photosynthetic electron transport chain, delivers reducing equivalents to TRXs, allowing the reduction of redox sensitive targets in response to light, and, via FDX-NADP reductase (FNR) and NADPH, to NTRC. The severe phenotype of Arabidopsis mutants combining the deficiencies of NTRC and TRXs f [59,60], and TRX x [59], which are suppressed by decreased contents of 2-Cys PRXs [40,61] allows to link the reducing capacity of these TRXs with the NTRC-2-Cys PRXs system (Fig. 8, green pathway). In the light, NTRC maintains the redox balance of 2-Cys PRXs thereby avoiding drainage of electrons from TRXs (Fig. 8, dotted green arrow). This has been shown for typical TRXs of the types x, f, and m, but it is likely that affects other TRXs. In the dark, 2-Cys PRXs mediate the transfer of reducing equivalents to hydrogen peroxide with the participation of oxidizing TRXs such as ACHT1 [34], ACHT4 [35] and TRX L2 [32] (Fig. 8, red pathway), though typical TRXs might also contribute to this oxidative pathway as suggested by in vitro assays showing the participation of TRXs f and 2-Cys PRX in the oxidation of fructose-1,6-bisphosphatase, among other redox regulated proteins [32,41,42]. Though not analyzed in this work, atypical PRX Q and PRX IIE, as well present in Arabidopsis chloroplasts [15,16], seem to have a minor role in chloroplast redox homeostasis [41]. While PRX Q can be reduced by TRXs y [30], PRX IIE was shown to be regenerated by glutaredoxin (GRX) rather than by TRXs [62,63]; moreover, the interaction of PRX IIE with 14-3-3 proteins suggests that the role of this PRX in redox signaling is unrelated with its peroxidase activity [62]. In contrast with 2-Cys PRXs, the effect of GPXs is independent of NTRC, as suggested by the similar phenotypes of the ntrc and ntrc-gpx1gpx7 mutants (Fig. 5A, C, D; Figs. S1A–C), and the inability of NTRC to reduce GPXs 1 and 7 (Fig. 6A and B). Since the most efficient reductant of chloroplast GPXs is TRX y2 (Fig. 6C), as previously reported for the poplar enzyme [22], the effect of GPXs on chloroplast performance is likely exerted via these TRXs. In this regard, it is worth noting that in contrast with the severe phenotypes of the ntrc-trxf1f2 and ntrc-trxx mutants [59], the ntrc-trxy1y2 mutant shows a phenotype like the ntrc mutant [31]. Altogether, these results suggest that TRXs y are not controlled by the NTRC-2-Cys PRXs, but rather by GPXs (Fig. 8, grey pathway).
چکیده
1-مقدمه
2- مواد و روشها
2-1-مواد زیستی(بیولوژیکی) و شرایط رشد
2-2- توالی جهش های دوگانه، سه گانه و چهارگانه گیاه آرابیدوپسیس
2-3- استخراج پروتئین، سنجش آلکیلاسیون و تجزیه و تحلیل وسترن بلات
2-4-تعیین کلروفیل، اندازه گیری کلروفیل a
2-5- شبیه سازی، بیان و خالص سازی پروتئین های نوترکیب
2-6- تعیین وضعیت اکسایش-کاهش در شرایط آزمایشگاهی و سنجش فعالیت
3-نتایج
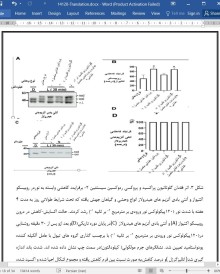
3-1- فقدان گلوتاتیون پراکسیدازها در کلروپلاست باعث تشدید فنوتیپ بازدارندگی رشد ناشی از فقدان پروکسی ردوکسین سیستئین 2-می شود
3-2-گلوتاتیون پراکسیدها و پروکسی ردوکسین سیستئین 2- به طور هماهنگ بر روی اکسیداسیون آنزیم کلروپلاست در تاریکی تاثیر می گذارد
3-3-فعالیت گلوتاتیون پراکسید های کلروپلاست مستقل از تیوردوکسین ردوکتاز است
3-4- فقدان همزمان کلروپلاست پروکسی ردوکسین سیستئین 2- و گلوتاتیون پراکسیدها اثرات جزئی بر پاسخ گیاه به نور زیاد دارد
4-بحث
4-1-کلروپلاست گلوتاتیون پراکسیدها برای رشد گیاه در شرایط استاندارد غیر قابل استفاده هستند
4-2-فقدان همزمان کلروپلاست گلوتاتیون پراکسید و پروکسی ردوکسین سیستئین 2- بر تعادل اکسایش-کاهش اندامک و رشد گیاه تأثیر می گذارد.
4-3- اثر گلوتاتیون پراکسیدها بر تعادل اکسیداسیون و کاهش کلروپلاست مستقل از تیوردوکسین ردوکتاز است
5- نتیجه گیری
منابع
Abstract
Abbreviations
1. Introduction
2. Materials and methods
2.1. Biological material and growth conditions
2.2. Generation of Arabidopsis double, triple and quadruple mutans
2.3. Protein extraction, alkylation assays and Western blot analysis
2.4. Determination of chlorophylls, measurements of chlorophyll a fluorescence and determination of carbon assimilation rates
2.5. Cloning, expression, and purification of recombinant proteins
2.6. In vitro redox state determinations and activity assays
3. Results
3.1. The lack of chloroplast GPXs aggravates the growth inhibition phenotype caused by the lack of 2-Cys PRXs
3.2. GPXs and 2-Cys PRXs act concertedly on chloroplast enzyme oxidation in the dark
3.3. The activity of chloroplast GPXs is independent of NTRC
3.4. The simultaneous lack of chloroplast 2-Cys PRXs and GPXs has minor effects on plant response to high light
4. Discussion
4.1. Chloroplast GPXs are dispensable for plant growth under standard conditions
4.2. The simultaneous lack of chloroplast GPXs and 2-Cys PRXs affects the redox balance of the organelle and plant growth
4.3. The effect of GPXs on chloroplast redox balance is independent of NTRC
5. Conclusion
Funding
Declaration of competing interest
Acknowledgements
Appendix A. Supplementary data
Data availability
References
این محصول شامل پاورپوینت ترجمه نیز می باشد که پس از خرید قابل دانلود می باشد. پاورپوینت این مقاله حاوی 24 اسلاید و 5 فصل است. در صورت نیاز به ارائه مقاله در کنفرانس یا سمینار می توان از این فایل پاورپوینت استفاده کرد.
در این محصول، به همراه ترجمه کامل متن، یک فایل ورد ترجمه خلاصه نیز ارائه شده است. متن فارسی این مقاله در 9 صفحه (2500 کلمه) خلاصه شده و در داخل بسته قرار گرفته است.
علاوه بر ترجمه مقاله، یک فایل ورد نیز به این محصول اضافه شده است که در آن متن به صورت یک پاراگراف انگلیسی و یک پاراگراف فارسی درج شده است که باعث می شود به راحتی قادر به تشخیص ترجمه هر بخش از مقاله و مطالعه آن باشید. این فایل برای یادگیری و مطالعه همزمان متن انگلیسی و فارسی بسیار مفید می باشد.
بخش مهم دیگری از این محصول لغت نامه یا اصطلاحات تخصصی می باشد که در آن تعداد 57 عبارت و اصطلاح تخصصی استفاده شده در این مقاله در یک فایل اکسل جمع آوری شده است. در این فایل اصطلاحات انگلیسی (تک کلمه ای یا چند کلمه ای) در یک ستون و ترجمه آنها در ستون دیگر درج شده است که در صورت نیاز می توان به راحتی از این عبارات استفاده کرد.
- ترجمه فارسی مقاله با فرمت ورد (word) با قابلیت ویرایش و pdf بدون آرم سایت ای ترجمه
- پاورپوینت فارسی با فرمت pptx
- خلاصه فارسی با فرمت ورد (word)
- متن پاراگراف به پاراگراف انگلیسی و فارسی با فرمت ورد (word)
- اصطلاحات تخصصی با فرمت اکسل