
دانلود رایگان مقاله ویژگی های ترمودینامیک پارتیشن غشاء- آب در یک لیپوپپتید
چکیده
برای روشن کردن نیروی محرکه برای اثر آبگریزی که لیپوپروتئین های آمفیفیلیک را بین آب و غشاء تقسیم می کند، یک تجزیه و تحلیل ترمودینامیکی اتمی مفصل را در یک بلوک هپتاپپتید H-ras اصلاح شده چربی سه برابر (ANCH) در آب و در یک چربی های دولایه دارای دو لایه لیپیدیDMPC (1,2-dimyristoyl-sn-glycero-3-phosphocholine) انجام دادیم. با ترکیب رویکردهای حلال مکانیکی و زنجیره مولکولی با یک روش بهبود یافته برای محاسبه آنتروپی جسم حل شده، یک انرژی آزاد انتقال کلی را به دست آوردیم؛ این مقدار دارای سازگاری کیفی با تغییرات انرژی آزاد به دست آمده از یک پتانسیل محاسبه نیروی متوسط و مشاهدات تجربی غیر مستقیم است. تغییرات در انرژی های آزاد حلال پوشی و سازماندهی مجدد ساختاری ANCH, نامطلوب هستند، در حالی که فعل و انفعالات ANCH-DMPC- به خصوص واندروالس- به نفع جاگذاری هستند. این نتایج با یک اثر آبگریز آنتالپی-محور سازگار است، و موافق با داده های کالریمتری قبلی در مورد تقسیم بندی غشاء دیگر آمفیلی ها. علاوه بر این، تجزیه و تحلیل ساختاری و آنتروپی مولکولی گروه های تولیدشده-دینامیک نشان می دهد که انتخاب کنفورماسیونی (انطباقی) می تواند نقشی را در وارد نمودن غشاء پپتیدهای چربی-اصلاح شده و پروتئین ها ایفا کند که تاکنون به آن توجه نشده است.
مقدمه
انتقال ترکیبات غیرقطبی (آبگریز یا متنفر از-آب) به غشاهای چربی معمولاً به اثر آبگریزی نسبت داده می شود. در اصل (1), فرض می شود که نیروی محرکه برای اثر آبگریز آنتروپیک است. دلیلش این است که چون تغییر آنتروپی، DS ، با انتقال مولکول های کوچک غیر قطبی مانند بنزن و هگزان از فاز خالص به آب, بزرگ و در دمای اتاق منفی است؛ آنتالپی مربوطه، DH ، حدوداً صفر یا تنها اندکی منفی است. تفسیر مولکولی مرسوم این مشاهده اینست که ورود مولکول ناقطبی در آب در الگوی پیوند-هیدروژنی مولکولهای آب پیرامون اختلال ایجاد می کند. در صورت عدم وجود فعل و انفعالات آب-جسم حل شده برای جبران این اثر، فعال و انفعال قوی تر در بین مولکولهای آب در اطراف جسم حل شده موجب نظم به اصطلاح '' اندرون ها '' (1)، '' کوه های یخ '' (2)، و یا '' خوشه های آشفته '' (3) می شود. انتشار و سازماندهی مجدد این مولکول های آب منظم به محض انتقال جسم حل شده به فاز خالص, منشاء آنتروپیک اثر آبگریز (1) را توضیح می دهد. این فرآیند انتقال توسط بستگی قوی تغییر ظرفیت گرمایی ( DCp) به وروده حرارت مشخص می شود، که می تواند توسط مصرف گرما برای ''ذوب کردن'' کوه یخ توضیح داده شود. به طور مشابه، ارتباط بین شکل گیری واسطه ها (مانند آب-غشاء) و اثر آبگریز برای اجسام حل شده بزرگ توسط جابجایی مولکول های آب به دور از سطوح جسم حل شده غیر قطبی (4) و یا خیسی زدایی (5) توصیف شده است.
تقسیم مولکول های کاملا آبگریز به مدل و یا غشاهای زیستی سازگار با این تصویر '' کلاسیک '' از اثر آبگریز است، یعنی، اثرات حلال, موجب ورود می شوند. در واقع، انتقال یک سری از تری پپتیدهای آبگریز به غشاء چربی با آنتروپی مثبت بزرگ (مطلوب) و آنتالپی صفر (تقریبی) (6) مرتبط است. در مقابل، انتقال مولکول های آمفیفیلیک از فاز آبی به غشای لیپیدی می تواند به صورت آنتالپی یا آنتروپی محور باشد. به عنوان مثال، اگر چه آنتروپی بر انرژی آزاد انتقال غشاء دیبوکاین بی حسی موضعی باردار مثبت غالب است، همان آزمایشات کالریمتری, اثرات آبگریز آنتالپی-محور را برای 2-(p-toluidinyl)naphthalene-6-sulfonate رنگی حساس-پتانسیل یافتند. هدایت غشاء موجب القا تترافنیلبورات آنیون و آملودیپین مسدود کننده کانال (7) می شود.
این داده ها نشان می دهند که نیروی محرکه برای اثر آبگریز مسئول تقسیم شن ترکیبات آمفیفیلیک بین آب و غشاء نمی تواند به عنوان نیروی ناشی از سازماندهی مجدد حلال عمومیت یابد. اثرات آب گریز آنتالپی-محور نیز در ارتباطات دارو-پروتئین (8) یافت شده اند. همچنین تفسیر متعارف اثر آبگریز توسط دشواری تمایز بین جسم حل شده و اثرات حلال پیچیده می شود. اولاً، انرژی جاذبه واندروالس (VDW) بین مولکولهای غیرقطبی در فاز مایع می تواند آنتالپی هیدراتاسیون (9) را بپوشاند. به عنوان مثال، در حالی که آنتالپی کلی دمای اتاق در ارتباط با انتقال یک مولکول بنزن به آب نزدیک به صفر است، انرژی فعال و انفعال vdW اندازه گیری شده توسط گرمای تبخیر, مثبت است ، که آنتالپی هیدراتاسیون منفی (10) را نشان می دهد. دوماً، به مدت طولانی اذعان شده است که جداسازی نسبت حلال و حل شونده در آنتروپی توسط روش های تجربی (8،11) و یا با تکنیک های محاسباتی رایج (12) مشکل است. در واقع، تخصیص آنتروپی انتقال به سازماندهی مجدد آب تنها زمانی معتبر است که سازماندهی مجدد جسم حل شده ناچیز باشد، که معمولاً چنین نیست.
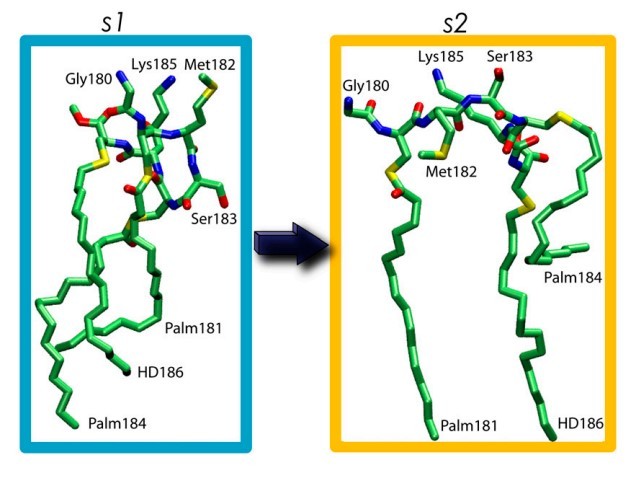
برای روشن کردن این مسائل، ما به صراحت نسبت های مرتبط با حل شونده و حلال در انرژی آزاد انتقال (و یا ورود) یک لیپوپپتید آمفیفیلیک در یک چربی های دولایه دارای دو لایه لیپیدی 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) را محاسبه نمودیم. یک هپتاپپتید چربی-اصلاح شده سه برابر به نمایندگی از بلوک غشای H-ras (ANCH) به عنوان یک سیستم مدل استفاده شد. H-ras متعلق به خانواده Ras GTPases است که تنظیم کننده های بسیار مهم سیگنالینگ سلولی هستند. آنها واسطه تکثیر، رشد، و آپوپتوز سلولی هستند, زمانی که به غشاء متصل شده باشند، به خصوص کاسبرگ داخلی غشای پلاسمایی. هدف قرار دادن غشاء از طریق اصلاح (های)-چربی پس-انتقالی (13) به دست می آید. در H-ras، این شامل فارنیسیلاسیون (که در اینجا توسط گروه هگزادسیل، HD مدلسازی شده است) در سیگنال CaaX ترمینال-C (a معمولاً نشان دهنده آلیفاتیک و X نشاندهنده هر اسید آمینه است) و پس از آن پالمیتویلاسیون (Palm) دو سیستئین مجاور می شود (شکل 1). توزیع زنجیره های جانبی قطبی و باردار (SER-183 و Lys-185) نسبت به Met-182 غیر قطبی و گروه های چربی-اصلاح شده (Palm181، Palm184 و HD186), به ANCH, کاراکتر آمفیفیلیک می دهد. با این حال، انعطاف پذیری دم های چربی بلند آن و عدم وجود یک هندسه تعریف شده در محلول, ANCH را در مقایسه با اشکال اصلی آمفیفیلیک اتصال دهنده-غشاء رایج، مانند مارپیچ های- (14)، پپتیدهای حاوی- TRP ((15) و منابع آن)، و یون های آبگریز حامل- حلقه (7) منحصر به فرد می سازد.
ANCH یک سیستم جالب به خودی خود و به عنوان یک مدل برای مطالعه نیروی محرکه اثر آبگریز برای تقسیم بندی غشاء پپتید (LIPO) است. اولاً، یک درک مفصل از ویژگی های ترمودینامیک ورود غشای آن از نظر بیولوژیک و دارویی با پیامدها برای درمان سرطان مهم است. دومً، اندازه متوسط آن, نمونه برداری گسترده از فضای پیکربندی توسط شبیه سازی های کامپیوتری را میسر می سازد. سوم، ساختار و ویژگی های دینامیکANCH متصل شده-غشایی، و همچنین مکانیسم ورود و پتانسیل مرتبط با نیروی متوسط (PMF)، قبلاً با جزئیات (16-18) شناخته شده است. اطلاعات تجربی قابل توجه نیز دردسترس هستند (19-21). به علاوه، ساختار سنتی و آمفی فیلیسیته منحصر به فرد ANCH, یک چشم انداز تازه را برای یک مسئله قدیمی ارائه می دهد.
ما از شبیه سازی های دینامیک مولکولی (MD) برای تولید گروه های ساختاری ANCH در آب و در یک چربی های دولایه دارای دو لایه لیپیدی DMPC استفاده نمودیم. این گروه ها برای ارزیابی کمیت های ترمودینامیکی استفاده شدن. آنتروپی پیکربندی جسم حل شده توسط یک تجزیه و تحلیل شبه هارمونیک کامل اصلاح شده برای عدم هارمونی ها و ارتباطات دو به دو و آنتروپی های خارجی توسط یک رویکرد توزیع احتمال مورد ارزیابی قرار گرفت. انرژی های داخلی و حلال پوشی توسط مدل های حلال پوشی مکانیکی و زنجیره مولکولی برآورد شد. ما دریافتیم که اثر آبگریز مسئول انتقال آب به غشاء ANCH, آنتالپی محور است. علاوه بر این، یک تجزیه و تحلیل ساختاری و آنتروپی ترکیبی در ANCH نشان می دهد که انتخاب کنفورماسیونی (انطباقی) می تواند نقش مهمی در اتصال غشاء ایفا کند.
روش ها
توزیع تعادل ANCH در دمای T (310 K در این کار) بین آب و غشاء را می توان با قرار دادن انرژی آزاد، توصیف نمود؛ (معادله 1), DGins ¼ DH TDSتغییرات در آنتالپی (DH ) و آنتروپی ( DS) ناشی از تغییرات در فعال و انفعال و سازماندهی مجدد اتم در داخل و بین ANCHهپتاپپتید، p، غشاء، m، و آب، w (معادله 2) است.
ABSTRACT
To shed light on the driving force for the hydrophobic effect that partitions amphiphilic lipoproteins between water and membrane, we carried out an atomically detailed thermodynamic analysis of a triply lipid modified H-ras heptapeptide anchor (ANCH) in water and in a DMPC (1,2-dimyristoyl-sn-glycero-3-phosphocholine) bilayer. Combining molecular mechanical and continuum solvent approaches with an improved technique for solute entropy calculation, we obtained an overall transfer free energy of ;13 kcal mol1 . This value is in qualitative agreement with free energy changes derived from a potential of mean force calculation and indirect experimental observations. Changes in free energies of solvation and ANCH conformational reorganization are unfavorable, whereas ANCH-DMPC interactions—especially van der Waals—favor insertion. These results are consistent with an enthalpy-driven hydrophobic effect, in accord with earlier calorimetric data on the membrane partition of other amphiphiles. Furthermore, structural and entropic analysis of molecular dynamics-generated ensembles suggests that conformational selection may play a hitherto unappreciated role in membrane insertion of lipid-modified peptides and proteins.
INTRODUCTION
Transfer of nonpolar (hydrophobic or water-hating) compounds into lipid membranes is usually ascribed to the hydrophobic effect. The driving force for the hydrophobic effect is assumed to be entropic in origin (1). This is because the entropy change, DS, associated with the transfer of small nonpolar molecules such as benzene and hexane from the pure phase to water is large and negative at room temperature; the corresponding enthalpy, DH, is approximately zero or only slightly negative. The conventional molecular interpretation of this observation is that insertion of nonpolar molecules in water perturbs the hydrogen-bonding pattern of the surrounding water molecules. In the absence of water-solute interactions to compensate for this effect, stronger interaction among water molecules around the solute causes ordering into so-called ‘‘clathrates’’ (1), ‘‘icebergs’’ (2), or ‘‘flickering clusters’’ (3). The release and reorganization of these ordered water molecules upon the transfer of the solute to the pure phase explains the entropic origin of the hydrophobic effect (1). This transfer process is also characterized by a strong temperature dependence of the heat capacity change (DCp), which can be explained by the consumption of heat to ‘‘melt’’ the iceberg. Similarly, the connection between the formation of interfaces (such as water-membrane) and the hydrophobic effect for large solutes has been described by the displacement of water molecules away from nonpolar solute surfaces (4) or dewetting (5).
Partitioning of purely hydrophobic molecules into model or biological membranes is consistent with this ‘‘classical’’ picture of the hydrophobic effect, namely, solvent effects drive insertion. Indeed, the transfer of a series of hydrophobic tripeptides to lipid membrane is associated with large positive (favorable) entropy and (nearly) zero enthalpy (6). In contrast, the transfer of amphiphilic molecules from aqueous phase to lipid membrane can be either enthalpy or entropy driven. For instance, although entropy dominates the membrane transfer free energy of the positively charged local anesthetic dibucaine, the same calorimetric experiments found enthalpydriven hydrophobic effects for the potential-sensitive dye 2-(p-toluidinyl)naphthalene-6-sulfonate, the membrane conductivity inducing anion tetraphenylborate, and the Ca21 channel blocker amlodipine (7).
These data demonstrate that the driving force for the hydrophobic effect responsible for the partition of amphiphilic compounds between water and membrane cannot be generalized as arising from solvent reorganization. Enthalpy-driven hydrophobic effects have also been found in drug-protein associations (8). The conventional interpretation of the hydrophobic effect is further complicated by the difficulty of distinguishing between solute and solvent effects. First, the van der Waals (vdW) attraction energy between apolar molecules in the liquid phase can mask the hydration enthalpy (9). For example, whereas the overall room temperature enthalpy associated with the transfer of a benzene molecule to water is close to zero, the vdW interaction energy measured by the heat of vaporization is positive (;16 kcal mol1 ), suggesting a negative hydration enthalpy (10). Second, it has long been appreciated that the solvent and solute contributions to entropy are hard to separate by experimental procedures (8,11) or by common computational techniques (12). In fact, the assignment of the entropy of transfer to water reorganization alone is valid only when the solute reorganization is negligible, which is typically not the case.
To shed light on these issues, we explicitly calculated the solute- and solvent-related contributions to the free energy of transfer (or insertion) of an amphiphilic lipopeptide into a 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) bilayer. A triply lipid-modified heptapeptide representing the H-ras membrane anchor (ANCH) was used as a model system. H-ras belongs to the family of Ras GTPases that are crucial regulators of cellular signaling. They mediate cell proliferation, development, and apoptosis when bound to membranes, especially the inner leaflet of the plasma membrane. Membrane targeting is achieved through posttranslational lipid-modification(s) (13). In H-ras, this involves farnesylation (modeled here by a hexadecyl group, HD) at the C-terminal CaaX signal (a usually represents aliphatic and X any amino acid) followed by palmitoylation (Palm) of two adjacent cysteine residues (Fig. 1). The distribution of the polar and charged side chains (Ser-183 and Lys-185) relative to the nonpolar Met-182 and the lipid-modified groups (Palm181, Palm184, and HD186) gives ANCH an amphiphilic character. However, the flexibility of its long lipid tails and lack of a defined geometry in solution makes ANCH unique when compared with common membrane-binding amphiphilic motifs, such as a-helices (14), Trp-containing peptides ((15) and references therein), and ring-carrying hydrophobic ions (7).
ANCH is an interesting system both in itself and as a model for studying the driving force of the hydrophobic effect for (lipo)peptide membrane partitioning. First, a detailed understanding of its membrane insertion thermodynamics is biologically and pharmacologically important with implications for cancer therapy. Second, its moderate size allows an extensive sampling of configurational space by computer simulations. Third, the structure and dynamics of membranebound ANCH, as well as the mechanism of insertion and the associated potential of mean force (PMF), have already been characterized in detail (16–18). Substantial experimental information is also available (19–21). Furthermore, the nonconventional structure and unique amphiphilicity of ANCH provide a fresh perspective into an old problem.
We used molecular dynamics (MD) simulations to generate structural ensembles of ANCH in water and in a DMPC bilayer. These ensembles were used to evaluate thermodynamic quantities. Solute configurational entropy was evaluated by a complete quasiharmonic analysis corrected for anharmonicities and pairwise correlations and external entropies by a probability distribution approach. Internal and solvation energies were estimated by molecular mechanical and continuum solvation models. We found that the hydrophobic effect responsible for the water-to-membrane transfer of ANCH is enthalpy driven. Furthermore, a combined structural and entropic analysis of ANCH suggests that conformational selection may play a significant role in membrane binding.
METHODS
The equilibrium distribution of ANCH at temperature T (310 K in this work) between water and membrane can be described by the insertion free energy, DGins; (Eq. 1), DGins ¼ DH TDS: (1) Changes in enthalpy (DH) and entropy (DS) arise from changes in interaction and reorganization of atoms within and between the heptapeptide ANCH, p, membrane, m, and water, w (Eq. 2).
چکیده
مقدمه
روش ها
MM-PBSA
جزئیات شبیه سازی
آنتروپی جسم حل شده و انرژی های آزاد اغتشاش غشایی
نتایج و بررسی
انطباق تطابقی پپتید
ورود پپتید
ویژگی های دینامیک ستون فقرات, انتخاب تطابقی را پیشنهاد می دهد
دینامیک دم های لیپید, از انتخاب تطابقی پشتیبانی می کند
ملاحظات فیزیکی-شیمیایی و آزمایشات اولیه
منابع
ABSTRACT
INTRODUCTION
METHODS
MM-PBSA
Simulation details
Solute entropy and membrane perturbation free energies
RESULTS AND DISCUSSION
Peptide conformational adaptation
Peptide insertion
Backbone dynamics suggests conformational selection
Dynamics of the lipid tails supports conformational selection
Physicochemical considerations and earlier experiments
REFERENCES
