
دانلود رایگان مقاله مکانیسم انتخاب حمل و نقل در سیتوپلاسم برای مسیر هدف یابی واکوئل
خلاصه
عملکرد مناسب اندامکهای یوکاریوتی تا حد زیادی وابسته به بسته بندی خاص پروتئین های حمل و نقل در داخل کیسه های کوچک تحویل گذرا است. مسیر هدف یابی سیتوپلاسم به واکوئل (CVT)، مسیر ترافیک مربوط به اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) است که پروتئین ها، aminopeptidase I و αmannosidase را حمل و نقل می کند، به طور انتخابی از سیتوپلاسم به واکوئل شبه-لیزوزوم مخمر حمل و نقل می شود. این مطالعه، یک مکانیسم مولکولی برای حمل و نقل ویژگی در این مسیر شامل چهار مرحله مجزا را روشن می کند. گیرنده Cvt19، نقش مرکزی را در این فرایند ایفا می کند: حوزه های مجزا در Cvt19، پروتئین محموله چندپاره شده را شناسایی می کند و آنها را به ماشین آلات تشکیل کیسه های کوچک از طریق تعامل با Cvt9 و Aut7 ارتباط می دهد. از آنجا که اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه)، مکانیسم اولیه برای گردش ارگان سلولی است، این نتایج، بینشی را به فرایندهای فیزیولوژیکی در هموستاز سلولی، از جمله بسته بندی خاص اندامکهای آسیب دیده و یا اضافی برای تحویل لیزوزومی و تجزیه بحرانی ارائه می دهد.
مقدمه
مسیر اصلی برای نابودی سلول آسیب دیده یا ارگان سلولی، یک فرایند سلولی مسئول تخریب بخش عمده ای از اجزای سیتوپلاسمی در سلول های یوکاریوتی است. در این فرایند، مواد سیتوپلاسمی به طور غیرانتخابی توسط وزیکول های غشا، دو اتوفاگوزوم به لیزوزوم / واکوئل حمل و نقل می شود که باید تخریب شود (Klionsky و Ohsumi ، 1999 ) اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) ( APG) از شرایط گرسنگی ناشی می شود. اندامکها نیز توسط اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) زمانی که آنها آسیب می بینند و یا دیگر مورد نیاز نیستند دستخوش حذف انتخابی می شوند (Klionsky وEMR ، 2000). علاوه بر این، آنزیم های مقیم حفره از یک فرایند مربوط به اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) به نام مسیر هدف یابی سیتوپلاسم به واکوئل (CVT) بهره برداری می کنند (Klionsky وOhsumi ، 1999). i Aminopeptidase ( Ape1)، محموله مسیر CVt (CVT)، در سیتوپلاسم به عنوان یک فرم پیشرو (prApe1) تولید می شود. propeptide prApe1 حاوی اطلاعات هدف یابی حفره می شود (ODA و همکاران، 1996؛ Segui واقعی و همکاران، 1995). پس از سنتز، prApe1 به dodecamer مونتاژ می شود (Kim و همکاران، 1997) که بیشتر در یک ساختار منحصر به فرد به نام کمپلکس CVT (Baba و همکاران، 1997) بسته بندی می شود. این کمپلس متعاقبا توسط یک غشاء دوبل به شکل وزیکول CVT احاطه می شود. این وزیکول سپس با واکوئل برای انتشار تک وزیکول غشای داخلی، بدنه CVT، ترکیب می شود (Baba و همکاران، 1997 ؛ Scott و همکاران، 1997). در دهه گذشته، مطالعات مورفولوژیکی ، ژنتیکی و بیوشیمیایی در مخمر Saccharomyces cerevisiae نشان داده است که اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) ، تخریب پراکسیزوم ( pexophagy ) و مسیر CVt (CVT) یک مکانیزم رایج را برای پیدایش حیات وزیکول های دو غشایی به اشتراک می گذارد که جدا کننده محموله از سیتوپلاسم است ( Klionsky و Ohsumi ، 1999؛ Reggiori و Klionsky ، 2002). با این حال ، مکانیزم مورد استفاده برای ترکیب انتخابی محموله به این وزیکول نامشخص است.
به تازگی، یک پروتئین جدید، به نام Cvt19 ، شناسایی شده است و به عنوان یک گیرنده برای محموله های CVT، prApe1 و mannosidase α (Ams1 ) مشخص می شود ( Hutchins Klionsky ، 2001 ، Scott و همکاران، 2001). Cvt19 یک پروتئین غشای محیطی است. بر خلاف گیرنده های نوع گذرنده از غشاء معمولی که چند دور اتصال و آزادی را به دست می آورند، Cvt19 همراه با محموله خود به واکوئل منتقل و توسط پروتئیناز حفره ای تخریب می شود. تجزیه و تحلیل بیوشیمی و میکروسکوپ فلورسانس نشان می دهد که Cvt19 در درجه اول در یک ساختار پیش حفره ای preautophagosomal (PAS)، یک محل پیش بینی برای تشکیل وزیکول واقع می شود که در آن بسیاری از اجزای مورد نیاز برای اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) و مسیر CVT واقع می شوند (Scott و همکاران، 2001 ، Suzuki و همکاران، 2001، Kim و همکاران، 2002 ؛ Noda و همکاران، 2002). از این نتایج، Cvt19 برای عمل نمودن در مرحله ای پیشنهاد می شود که در آن کمپلکس CVT به PAS هدف یابی می کند. با این حال، روشن نیست چگونه Cvt19 در به این محل موقعیت یابی می شود. اگرچه اجزاء خاص برایCVT و مسیرهای pexophagy ، مانند Cvt9، شناسایی شده اند (Scott و همکاران، 2000 ؛ Kim و همکاران، 2001b ؛ . nice و همکاران، 2002) ، رابطه بین Cvt19 و این پروتئین ها هنوز نامعلوم است.
در این مطالعه، ما به مکانیزم مولکولی حمل و نقل انتخابی محموله های CVT به واکوئل پرداخته ایم. نقشه برداری از حوزه های عملکردی در Cvt19، محل های اتصال جداگانه را برای تعامل با دو پروتئین حمل و نقل شناسایی نموده است (prApe1 و Ams1)، CVt (CVT) مسیر/عامل pexophagy خاص Cvt9 و CVt (CVT) وزیکول / جزء اتوفاگوزوم. با استفاده از این، همراه با تجزیه و تحلیل میکروسکوپ فلورسانس و جداسازی پیوستگی، ما نتیجه گیری کردیم که روند هدف یابی محموله های انتخابی به PAS شامل زیرکمپلکس های خاص از پروتئین های APG / CVT می شود که در یک نظم زمانی خاص عمل می کنند و اجازه می دهد تا شکل گیری کمپلکس CVT (Ape1Cvt19 Ams1) و الحاق آن به جداکننده وزیکول ها صورت گیرد.
نتایج
GFP-Ape1 توسط مسیرهای CVT و اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) به واکوئل منتقل می شود
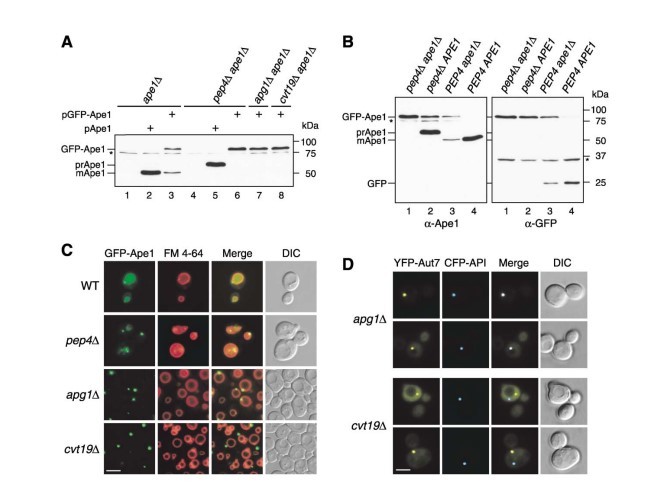
I (Ape1) Aminopeptidas هیدرولاز ساکنی است که از طریق مسیر هدفیابی سیتوپلاسم به واکوئل (CVT) به واکوئل حرکت می کند. propeptide N-ترمینال حاوی اطلاعات هدف یابی حفره است و به روش وابسته به پروتئیناز حفره ای (Pep4) پس از تحویل شکافته می شود (شکل 1a، خطوط 2 و 5، Klionsky و همکاران، 1992؛ 1996 ODA و همکاران). تا به امروز، بسیاری از مطالعات اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) روی تجزیه و تحلیل دستگاه های تشکیل وزیکول متمرکز شده است. برای کسب اطلاعات بیشتر در مورد CVt (CVT) و معابر APG، ما تصمیم به بررسی واردات محموله پیش ساز پروتئین Ape1 (prApe1) در داخل بدن گرفتیم.
بر این اساس، ما یک همجوشی پروتئین فلورسنت سبز (GFP) N-ترمینال را با prApe1 ساختیم. GFP حاصل، Ape1 تحت کنترل پروموتر APE1 درونزاد از یک پلاسمید تک نسخه بیان می شود. به منظور تایید این مورد که این ساختار منعکس کننده ترافیک پروتئین بومی prApe1 است، ما ابتدا فرآوری GFP-Ape1 را در پس زمینه ape1 مورد بررسی قرار دادیم. Western blots نشان داد که حدود 50٪ GFP-Ape1، توسط برش prApe1 propeptide فرآوری می شود و نتیجه، تولید فرم بالغ Ape1 (mApe1) و GFP (شکل 1a و 1b، خط 3) است. تحت شرایط مشابه، prApe1 معتبر به طور کامل فرآوری می شود (شکل 1A، خط 2). در سلول های ape1α pep4Δ ، هیچ فرآوری GFP-Ape1 مشاهده نشد (شکل 1A، 6 و شکل 1B، کوچه 1).این نتایج نشان داد که GFP-Ape1 به mApe1 در یک روش وابسته به پروتئیناز حفره و کارآمد به عنوان پروتئین بومی فرآوری می شود.
برای تایید بیشتر این مورد که آیا فرآوری GFP-Ape1، وابسته به مسیر CVT است یا خیر، ما GFP-Ape1 را در کشش های اα apg1α و ape1α cvt19Δ بیان نمودیم. Apg1 سرین / ترئونین کیناز پروتئین ضروری برای تشکیل وزیکول / اتوفاگوزوم CVT است ( Kamadaو همکاران، 2000 Scott و همکاران، 2000). Cvt19 اخیرا به عنوان یک گیرنده برای پروتئین باری نشان داده شده است که از مسیر CVt (CVT) (Leber و همکاران، 2001 Scott و همکاران، 2001) برای عملکرد خود استفاده می کند. در هر دو کشش، GFP-Ape1 به شکل فرآوری نشده (شکل 1a، خطوط 7 و 8) باقی می ماند که نشان می دهد GFP-Ape1 از طریق مسیر CVt (CVT) به واکوئل تحویل داده می شود. Ape1 پیشرو در dodecamer در سیتوزول مونتاژ می شود (Kim و همکاران، 1997). از آنجا که به نظر می رسید GFP-Ape1 به طور ناکارآمدتر از prApe1 معتبر در سلول های ape1 فرآوری می شود، اثر حضور prApe1 درونی در فرآوری GFP-Ape1 را مورد بررسی قرار میدهیم.GFP Ape1 در نوع وحشی و سلول های pep4Δ بیان شد و توسط Western blots با هر دو ضد Ape1 و آنتی سرم ضد GFP تجزیه و تحلیل شد. در سلول های pep4Δ، فرآوری هر دو GFP-Ape1 و prApe1 درونزا مهار شد (شکل 1B، خط 2)، در حالی که بیش از 95٪ GFP-Ape1، در سلول های نوع وحشی (شکل 1B، خط 4) به mApe1 تبدیل شد. این نتایج نشان داد که حضور درونزاد prApe1 فرآوری GFP-Ape1 را تسهیل می کند. از GFP مجاور به prApe1 ممکن است روی برخی از عملکردهای propeptide تاثیر می گذارد، به عنوان مثال، در تعامل با پروتئین های دیگر (پایین را ببینید. Scott و همکاران، 2001)، که می تواند با تشکیل یک چندپارهخ با prApe1 بومی ترمیم شود.
سپس ما به بررسی محل GFP - Ape1 در کشش های جهش یافته نوع وحشی و APG / aut / CVt (CVT) پرداختیم. ظهور سلول GFP Ape1 با FM 4-64 رنگی برای تجسم غشاء واکوئل برچسب زده شد و بوسیله میکروسکوپ فلورسانس مورد بررسی قرار گرفت. در سلول های نوع وحشی ، سیگنال GFP به طور یکنواخت در واکوئل با یک یا چند سیگنال نقطه کوچک در منطقه پیش حفره ای (شکل 1C)، در توافق با فرآوری کارآمد GFP - Ape1 (شکل 1B) پراکنده شد. ما بیشتر واردات GFP - Ape1 را در سلول های pep4Δ تایید کردیم که بدنه های CVT در لومن حفره تجمع می یابد. در این فشار، چندین نقطه GFP در حال حرکت در داخل واکوئل دیده شد که نشان می دهد GFP - Ape1 در داخل بدن CVT (شکل 1C) حاضر است. در مقابل، در کشش apg1Δ، یک نقطه بزرگتر GFP - Ape1 ، در منطقه پیش حفره ای، به جای داخل حفره لومن به نظر می رسد (شکل 1C). از آنجا که GFP - Ape1 به شکل یک نقطه بزرگ در جهش های APG / aut / CVT ( داده ها نشان داده نشده است) است، احتمال دارد که prApe1 به عنوان یک ساختار بزرگ در خارج از واکوئل وقتی مسیر CVT مسدود می شود، تجمع یابد. این مشاهدات با تجزیه و تحلیل های میکروسکوپ immunoelectron موافق است که نشان می دهد که prApe1 به واکوئل به عنوان بخشی از این کمپلکس CVT سفر می کند (Baba و همکاران، 1997) بودند. با در نظر گرفتن همه موارد، این نتایج نشان می دهد که محل حفره GFP - Ape1 ، CVt (CVT) وابسته به مسیر است و GFP - Ape1 به عنوان یک شاخص معتبر به دنبال واردات محموله از طریق مسیر CVT به کار گرفته می شود.
Propeptide prApe1 برای موقعیت یابی مناسب آن و تعامل با یک پروتئین گیرنده مورد نیاز است.
propeptide prApe1 برای واردات prApe1 به واکوئل ضروری است، اما برای اولیگومریزاسیون آن لازم نیست (ODA و همکاران، 1996 ؛ 1997 Kim و همکاران). یک پیش بینی ثانویه ساختار پیشنهاد داد که در که propeptide prApe1 به شکل یک ساختار مارپیچ-دور-مارپیچ است و اینکه اولین مارپیچ ( باقیمانده 1-18 ) نمایشگر ویژگی های amphipathic α مارپیچ است که برای ارتباط غشاء و فرآیندهای غشایی (ODA و همکاران، 1996) مهم است. جهش در این منطقه (به عنوان مثال، حذف باقی مانده های 9-11 ، 9-11) از ارتباط prApe1 با غشاء جلوگیری می کند و در نتیجه حمل و نقل آن به واکوئل را مهار می کند. از سوی دیگر، جایگزینی پرولین با لوسین در موقعیت 22 ( P22L ) باعث تجمع prApe1 در ساختار غشاء غیرحفره ای می شود، اما واردات prApe1 را به واکوئل مسدود می کند ( 1997 ODA و همکاران، 1996، Scott و همکاران) است. بنابراین ما سعی کردیم مرحله ای را در مسیر CVt (CVT) تعیین کنیم که از این جهش ها در prApe1 propeptide تحت تاثیر قرار می گیرد. ما بوسیله میکروسکوپ فلورسانس برای اولین بار تصمیم به بررسی موقعیت یابی prApe1 از جهش propeptide با استفاده از ساختار GFP در کششape1 α گرفتیم. GFP - Ape1 نوع-وحشی، یک رنگ آمیزی lumenal حفره ای قابل توجه را با سیگنال های خال خال کوچک اضافی در منطقه پیش حفره ای (شکل 2A) ارائه می دهد. در مقابل، GFP - Ape1 α 9-11 به طور یکنواخت در سیتوزول (شکل 2A ) توزیع می شود که موافق با تجزیه و تحلیل های بیوشیمیایی قبلی است. این نتیجه نشان می دهد که اولین مارپیچ amphipathic α در تشکیل کمپلکس Ape1 درگیر است. در مقابل،GFP - Ape1P22L یک سیگنال بزرگ تک خال خال را دور از واکوئل (شکل 2A ) ارائه داد که نشان می دهد که Ape1P22L هنوز قادر به تشکیل Ape1 پیچیده است، اما در موقعیت یابی PAS نقص دارد.
Abstract
The proper functioning of eukaryotic organelles is largely dependent on the specific packaging of cargo proteins within transient delivery vesicles. The cytoplasm to vacuole targeting (Cvt) pathway is an autophagy-related trafficking pathway whose cargo proteins, aminopeptidase I and α-mannosidase, are selectively transported from the cytoplasm to the lysosome-like vacuole in yeast. This study elucidates a molecular mechanism for cargo specificity in this pathway involving four discrete steps. The Cvt19 receptor plays a central role in this process: distinct domains in Cvt19 recognize oligomerized cargo proteins and link them to the vesicle formation machinery via interaction with Cvt9 and Aut7. Because autophagy is the primary mechanism for organellar turnover, these results offer insights into physiological processes that are critical in cellular homeostasis, including specific packaging of damaged or superfluous organelles for lysosomal delivery and breakdown.
Introduction
Macroautophagy is a cellular process responsible for bulk degradation of cytoplasmic components in eukaryotic cells. In this process, cytoplasmic materials are nonselectively sequestered by a double-membrane vesicle, the autophagosome, and transported to the lysosome/vacuole to be degraded (Klionsky and Ohsumi, 1999). Autophagy (Apg) is induced under starvation conditions. Organelles also undergo selective removal by autophagy when they are damaged or no longer needed (Klionsky and Emr, 2000). In addition, vacuolar resident enzymes exploit an autophagy-related process called the cytoplasm to vacuole targeting (Cvt) pathway (Klionsky and Ohsumi, 1999). Aminopeptidase I (Ape1), a cargo of the Cvt pathway, is synthesized in the cytoplasm as a precursor form (prApe1). The prApe1 propeptide contains vacuolar targeting information Oda et al. 1996, Segui-Real et al. 1995. After synthesis, prApe1 assembles into a dodecamer (Kim et al., 1997), which is further packaged into a unique structure called the Cvt complex (Baba et al., 1997). This complex is subsequently enwrapped by a double membrane to form the Cvt vesicle. This vesicle then fuses with the vacuole to release the inner single-membrane vesicle, the Cvt body Baba et al. 1997, Scott et al. 1997. In the last decade, morphological, genetic, and biochemical studies on the yeast Saccharomyces cerevisiae have demonstrated that autophagy, peroxisome degradation (pexophagy), and the Cvt pathway share a common mechanism for biogenesis of the double-membrane vesicles that sequester cargo from the cytoplasm Klionsky and Ohsumi 1999, Reggiori and Klionsky 2002. However, the mechanism used to selectively incorporate cargo into these vesicles has been unclear.
Recently, a novel protein, termed Cvt19, has been identified and characterized as a receptor for the Cvt cargos, prApe1 and α-mannosidase (Ams1) Hutchins and Klionsky 2001, Scott et al. 2001. Cvt19 is a peripheral membrane protein. Unlike typical transmembrane-type receptors that achieve multiple rounds of binding and release, Cvt19 is transported to the vacuole along with its cargo and is degraded by vacuolar proteinases. Biochemical and fluorescence microscopy analyses indicate that Cvt19 primarily localizes at a perivacuolar preautophagosomal structure (PAS), a predicted site of vesicle formation, where most components required for autophagy and the Cvt pathway localize Scott et al. 2001, Suzuki et al. 2001, Kim et al. 2002, Noda et al. 2002. From these results, Cvt19 is suggested to function at the step where the Cvt complex is targeted to the PAS. However, it is not clear how Cvt19 localizes to this site. Although components specific for the Cvt and pexophagy pathways, such as Cvt9, have been identified Scott et al. 2000, Kim et al. 2001b, Nice et al. 2002, the relationship between Cvt19 and these proteins remains unknown.
In this study, we addressed the molecular mechanism of selective transport of Cvt cargos to the vacuole. The mapping of functional domains in Cvt19 identified separate binding sites for interaction with two cargo proteins (prApe1 and Ams1), the Cvt pathway/pexophagy-specific factor Cvt9 and the Cvt vesicle/autophagosome component Aut7. Using this, together with fluorescence microscopy analyses and affinity isolation, we conclude that the process of selective cargo targeting to the PAS involves a specific subset of Apg/Cvt proteins that act in a particular temporal order to allow the formation of the Cvt complex (Ape1-Cvt19-Ams1) and its incorporation into sequestering vesicles.
Results
GFP-Ape1 Is Transported to the Vacuole by the Cvt and Autophagy Pathways
Aminopeptidase I (Ape1) is a resident hydrolase that travels to the vacuole via the cytoplasm to vacuole targeting (Cvt) pathway. Its N-terminal propeptide contains vacuolar targeting information and is cleaved off in a vacuolar proteinase A (Pep4)-dependent manner subsequent to delivery (Figure 1A, lanes 2 and 5; Klionsky et al. 1992, Oda et al. 1996). To date, most studies of autophagy have concentrated on analyses of the vesicle-forming machinery. To learn more about the Cvt and Apg pathways, we decided to examine import of the cargo protein precursor Ape1 (prApe1) in vivo. Accordingly, we constructed an N-terminal green fluorescent protein (GFP) fusion with prApe1. The resulting GFP-Ape1 chimera was expressed under the control of the endogenous APE1 promoter from a single-copy plasmid. To verify that this construct reflected the trafficking of the native prApe1 protein, we first examined the processing of GFP-Ape1 in the ape1Δ background. Western blot analysis revealed that about 50% of GFP-Ape1 was processed by cleavage of the prApe1 propeptide, resulting in the production of the mature form of Ape1 (mApe1) and GFP (Figures 1A and 1B, lane 3). Under the same conditions, authentic prApe1 was fully processed (Figure 1A, lane 2). In ape1Δ pep4Δ cells, no processing of GFP-Ape1 was observed (Figure 1A, lane 6 and Figure 1B, lane 1). These results indicated that GFP-Ape1 was processed to mApe1 in a vacuolar proteinase-dependent manner, although not as efficiently as the native protein.
To further confirm whether the processing of GFP-Ape1 was dependent on the Cvt pathway, we next expressed GFP-Ape1 in ape1Δ apg1Δ and ape1Δ cvt19Δ strains. Apg1 is a Ser/Thr protein kinase essential for Cvt vesicle/autophagosome formation Scott et al. 2000, Kamada et al. 2000. Cvt19 has recently been demonstrated to function as a receptor for cargo proteins that utilize the Cvt pathway Scott et al. 2001, Leber et al. 2001. In both strains, GFP-Ape1 remained in the unprocessed form (Figure 1A, lanes 7 and 8), indicating that GFP-Ape1 is delivered to the vacuole via the Cvt pathway. Precursor Ape1 assembles into a dodecamer in the cytosol (Kim et al., 1997). Because GFP-Ape1 seemed to be less-efficiently processed than authentic prApe1 in ape1Δ cells, we examined the effect of the presence of endogenous prApe1 on GFP-Ape1 processing. GFP-Ape1 was expressed in wild-type and pep4Δ cells and analyzed by Western blot with both anti-Ape1 and anti-GFP antisera. In pep4Δ cells, the processing of both GFP-Ape1 and endogenous prApe1 was blocked (Figure 1B, lane 2), whereas more than 95% of GFP-Ape1 was converted to mApe1 in the wild-type cells (Figure 1B, lane 4). These results indicated that the presence of endogenous prApe1 facilitated the processing of GFP-Ape1. The GFP-tagging adjacent to prApe1 may affect some function of the propeptide, e.g., the interaction with other proteins (see below; Scott et al., 2001), which can be restored by the formation of an oligomer with native prApe1.
We next investigated the localization of GFP-Ape1 in wild-type and apg/aut/cvt mutant strains. Cells expressing GFP-Ape1 were labeled with the dye FM 4-64, to visualize the vacuole membrane, and examined by fluorescence microscopy. In wild-type cells, the GFP signal was dispersed uniformly in the vacuole with one or a few tiny dot signals in the perivacuolar region (Figure 1C), in agreement with the efficient processing of GFP-Ape1 (Figure 1B). We further confirmed the import of GFP-Ape1 in pep4Δ cells that accumulate Cvt bodies in the vacuolar lumen. In this strain, several GFP dots were seen moving inside the vacuole, indicating GFP-Ape1 is present within the Cvt bodies (Figure 1C). In contrast, in the apg1Δ strain, a single larger dot of GFP-Ape1 appeared in the perivacuolar region, instead of inside the vacuolar lumen (Figure 1C). Because GFP-Ape1 forms a large dot in most apg/aut/cvt mutants (data not shown), it is likely that prApe1 accumulates as a large structure outside the vacuole when the Cvt pathway is blocked. These observations were in agreement with immunoelectron microscopy analyses showing that prApe1 travels to the vacuole as a part of the Cvt complex (Baba et al., 1997). Taken together, these results demonstrated that the vacuolar localization of GFP-Ape1 is Cvt pathway dependent and that GFP-Ape1 serves as a valid marker to follow cargo import through the Cvt pathway.
It has been reported that many proteins required for the Cvt and/or autophagic pathway localize at least transiently to the perivacuolar preautophagosomal structure (PAS), which is thought to be a site of vesicle formation Kim et al. 2001b, Suzuki et al. 2001, Noda et al. 2002, Nice et al. 2002. Many Apg/Aut/Cvt proteins accumulate at the PAS in apg mutant strains. We examined apg1Δ cells expressing CFP-Ape1 and YFP-tagged Aut7, one of the PAS components Kim et al. 2001a, Suzuki et al. 2001, by fluorescence microscopy. As shown in Figure 1D, CFP-Ape1 localized to the PAS that was labeled with YFP-Aut7 in the apg1Δ strain. Because the putative receptor protein Cvt19 also localizes to the PAS (Kim et al., 2002), we hypothesized that Cvt19 interacts with the prApe1 dodecamer at the PAS, leading to the formation of the Cvt complex. To test this idea, we examined the localization of GFP-Ape1 in a cvt19Δ strain by fluorescence microscopy. Unexpectedly, GFP-Ape1 still accumulated as a single large dot, but a careful observation revealed that it did not consistently localize in the perivacuolar region (Figure 1C). To determine whether GFP-Ape1 was concentrated at a site other than the PAS in the cvt19Δ strain, we transformed this strain with CFP-Ape1 and YFP-Aut7. As shown in Figure 1D, CFP-Ape1 was not seen at the PAS labeled with YFP-Aut7 in the cvt19Δ strain. This separate localization was also observed in an apg1Δ cvt19Δ strain (data not shown), indicating that cvt19 is epistatic to apg1 in controlling prApe1 localization to the PAS. These results suggested that prApe1 formed a large complex (referred to as the Ape1 complex) independent of Cvt19. However, the Cvt19 protein is required for the recruitment of the Ape1 complex to the PAS, in agreement with its presumed role as a receptor.
The prApe1 Propeptide Is Required for Its Proper Localization and the Interaction with a Receptor Protein
The prApe1 propeptide is essential for prApe1 import to the vacuole but is not required for its oligomerization Oda et al. 1996, Kim et al. 1997. A secondary-structure prediction suggested that the prApe1 propeptide forms a helix-turn-helix structure and that the first helix (residues 1–18) exhibits the characteristics of an amphipathic α helix, which is critical for membrane association (Oda et al., 1996). Mutations in this region (e.g., deletions of residues 9–11; Δ9–11) prevent prApe1 from associating with the membrane, thus inhibiting its transport to the vacuole. On the other hand, the substitution of proline to leucine at position 22 (P22L) causes accumulation of prApe1 on a nonvacuolar membrane structure but also blocks most of prApe1 import to the vacuole Oda et al. 1996, Scott et al. 1997. We therefore tried to determine the stage in the Cvt pathway that was affected by these mutations in the prApe1 propeptide. We first decided to verify the localization of prApe1 propeptide mutants using GFP-fused constructs in an ape1Δ strain by fluorescence microscopy. The wild-type GFP-Ape1 gave a significant vacuolar lumenal staining with additional small punctate signals in the perivacuolar region (Figure 2A). In contrast, GFP-Ape1Δ9–11 distributed uniformly in the cytosol (Figure 2A), in agreement with previous biochemical analyses. This result suggested that the first amphipathic α helix is involved in the formation of the Ape1 complex. In contrast, GFP-Ape1P22L gave a single large punctate signal away from the vacuole (Figure 2A), suggesting that Ape1P22L was still able to form the Ape1 complex but was defective in localization to the PAS.
خلاصه
مقدمه
نتایج
GFP-Ape1 توسط مسیرهای CVT و اتوفاژی (مکانیزم اصلی کاتابولیک شامل تخریب سلول یا اجزای سلولی بدون وظیفه) به واکوئل منتقل می شود.
Propeptide prApe1 برای موقعیت یابی مناسب آن و تعامل با یک پروتئین گیرنده مورد نیاز است.
کمپلکس Ape1-Cvt19 توسط Cvt9 تا PAS هدفمند است.
PreApe1 Cargo Ams1، Cvt9 و دیگر Arms1 پروتئین محموله به سمت گنجاندن های وزیکول های Cvt هدایت می کند.
CVT به وزیکول محموله های CVT
منابع
Summary
Introduction
Results
GFP-Ape1 Is Transported to the Vacuoleby the Cvt and Autophagy Pathways
The prApe1 Propeptide Is Required for Its ProperLocalization and the Interactionwith a Receptor Protein
The Ape1-Cvt19 Complex Is Targetedto the PAS by Cvt9
The Cargo Protein prApe1 Directs the Cvt19Receptor and Another Cargo Protein Ams1toward Incorporation into Cvt Vesicles
Discussion
Assembly and Recognition of the Cargo Complex
Targeting of the Cvt Complex to the Siteof Vesicle Formation
Mechanism for Selective Autophagy
Experimental Procedures
Strains and Media
Plasmid Construction
Biochemical Analysis
Fluorescence Microscopy
References
