
دانلود رایگان مقاله سلول های سوختی اکسید جامد تک-محفظه ای در درجه حرارت های متوسط
عملکرد سلول تک-محفظه ای سوخت اکسید جامد (SOFC) بین 350 و 900 درجه در ترکیبات جاری متان، اتان، پروپان، یا گاز مایع و هوا با یک نسبت حجمی 1 برای سوخت/ هوا مورد مطالعه قرار گرفت که در آن اکسیداسیون آنها با خیال راحت بدون انفجار انجام شد. در میان همه مواد الکترود آزمایش شده،Ni-Ce0.8Sm0.2O1.9 آلیاژ cermet و اکسید Sm0.5Sr0.5CoO3 به ترتیب به عنوان بهترین آند و کاتد در ترکیبات مختلف گاز عمل نمودند. یک سلول ساخته شده الکترولیت La0.9Sr0.1Ga0.8Mg0.2O3 با دو الکترود بیشتر از 900 میلی ولت در ترکیب متان و هوا بین 600 تا 800 درجه و در ترکیب اتان-هوا بین 450 و 650 درجه تولید شد. یک مقاومت کوچک در برابر واکنش برای الکترود، با کاهش ضخامت الکترولیت، منجر به افزایش چگالی توان شد. اوج چگالی توان در 450 درجه از 34 تا 101 میلی وات سانتی متر با کاهش ضخامت الکترولیت به اندازه 0.50-0.18 میلی متر افزایش یافت. مکانیزم کاری SOFC تک-محفظه ای در دماهای مختلف نیز با اندازه گیری فعالیت کاتالیزوری دو الکترود برای اکسیداسیون جزئی هیدروکربن ها مورد مطالعه قرار گرفت.
در سراسر جهان، علاقه به توسعه و تجاری سلول های سوخت برای وسایل نقلیه و دستگاه های برقی قابل حمل وجود دارد. این یک مفهوم در حال حاضر پذیرفته شده است که سلول های سوختی الکترولیت پلیمری (PEFCs) تنها دستگاه با قابلیت کار در دماهای پایین هستند. با این حال، ما معتقدیم، که PEFCs از نقطه نظر عملی کامل نمی باشد، چرا که آنها نیاز به هیدروژن به عنوان سوخت دارند که از لحاظ ذخیره سازی و حمل و نقل غیر عملی است. بنابراین، یک اصلاح خارجی باید برای تبدیل الکل های با دوام تر و هیدروکربن ها به هیدروژن، در نتیجه غلبه کردن بر قابلیت حمل مورد استفاده قرار گیرد. موفقیت های اخیر در مورد سلول های سوخت جامد اکسید (SOFCs) وجود داشته است که به خوبی بین 500 تا 700 درجه به طور مستقیم با استفاده از الکل و هیدروکربن ها به عنوان سوخت عمل نموده اند.کاهش بیشتر در درجه حرارت عملیاتی SOFCs اصلاح کننده- داخلی و افزایش مقاومت حرارتی و در برابر شوک مکانیکی، این تکنولوژی را به جایگزینی مطمئن برای PEFCs تبدیل نموده است.
نوع جدیدی از سلول سوختی که از سلول های سوخت متداول در طراحی و اصول متمایز است، توسط بسیاری از محققان پیشنهاد شده است. این سلول سوختی متشکل از تنها یک محفظه گاز است که در آن هر دو آند و کاتد در معرض ترکیب مشابه از سوخت و هوا قرار می گیرند. ما از یک سلول سوختی تک-محفظه ای (SCFC) به عنوان یک نماد برای این نوع از سلول سوختی استفاده خواهیم کرد. از آنجا که هیچ نیازی به جدا کردن منبع سوخت و هوا وجود ندارد، این سلول از نظر حرارتی و شوک مکانیکی، نسبت به سلول های سوختی معمولی، مقاوم است. ما به تازگی در استفاده از این طراحی سلول برای یک SOFC ساخته شده از الکترولیت زیرکونیا-ایتریا (YSZ) تثبیت شده با یک آند مبتنی بر نیکل و یک کاتد مگنتیت استرانسیوم دوپ لانتانیم (LSM) موفق بوده ایم. این SCFC نمایشگر چگالی توان بالا در ترکیب سیال متان و هوا است، اما باید در دمای بالای 950 درجه به منظور دستیابی به هدایت یونی کافی در الکترولیت جامد بهره برداری شود.
بهره برداری از SOFCs در درجه حرارت های کاهش یافته باعث تلفات بیش از حد اهمی و قطبش در سلول می شود. بنابراین، استفاده از یک الکترولیت بسیار رسانا همراه با یک آند و کاتد بسیار فعال لازم است. لانتانیم گالات یا اکسیدهای مبتنی بر سریا (ceria)، به دلیل رسانایی یونی بسیار بالاتر آنها نسبت به YSZ الکترولیت های امیدوار کننده ای خواهند بود. علاوه بر این، آلیاژهای نیکل-ceria و اکسیدهای perovskite مبتنی بر Co، که نشاندهنده هدایت یونی و الکترونیکی ترکیبی تحت هر یک از شرایط مربوطه می باشند، به طور کلی به ترتیب به عنوان آند و کاتد مناسب در درجه حرارت های کاهش یافته در نظر گرفته می شوند.
در این مطالعه، ما نشان می دهیم که بهره برداری SOFC مقاوم در برابر شوک از نظر حرارتی و مکانیکی در درجه حرارت های کاهش یافته با ترکیب مزایای استفاده از یک الکترولیت بسیار رسانا با طراحی سلول های تک-محفظه ای ممکن است. ما همچنین نشان می دهیم که اتان، پروپان و گاز مایع (LPG) را می توان با موفقیت به عنوان سوخت در SCFC حال حاضر، به ویژه در درجه حرارت عامل زیر 5508C استفاده نمود.
آزمایشی
شکل 1a نشاندهنده یک SCFC ساخته شده برای آزمون های سلول-سوخت در دماهای کاهش یافته است. La0.9Sr0.1Ga0.8Mg0.2O3 (LSGM),
Ce0.8Sm0.2O1.9 (SDC) و YSZ (8 مول % ایتریا) به عنوان الکترولیت استفاده شدند. هر دوی LSGM و SDC با فشار دادن پودرهای سرامیک تجاری خود (Anan Kasei) از نظر هیدروستاتیک در قرص های 2 3 103 kg cm22 و پس از آن پخت در هوای 1500 درجه به مدت 10 ساعت آماده شدند. پس از آن این قرص را به اندازه یک دیسک (حدود 14 میلی متر قطر، حدود 3 میلی متر ضخامت) با برنده الماسی قطع شد، سطح دیسک به ضخامت معین (0.18-0.50 میلی متر) با یک کاغذ ساینده، پولیش شد. دیسک YSZ متخلخل (14 میلی متر قطر، 0.5 میلی متر ضخامت) از سیمان Sumitomo Osaka خریداری شد. مگر در مواردی که بیان نشده بود، الکترولیت به ضخامت 0.5 میلی متر به عنوان نمونه استفاده شد.
فلز نیکل حاوی SDC [ نیکل ( SDC ) ] 10 درصد به عنوان آند استفاده شد. پودر NIO ( آزمایشگاه شیمی Kojundo ) با پودر SDC در اتیل کاربیتول ترکیب شد و سپس با یک ظرف آسیاب زیرکونیا و توپی های آسیاب زیرکونیا به مدت 1 ساعت آسیاب شد. همچنین فلزات نیکل ، پالادیم ، پلاتین به عنوان آند برای مقایسه مورد استفاده قرار گرفتند. این چسب ها بر روی یک سطح ( 0.5 منطقه CM2 ) از دیسک الکترولیت به اندازه ممکن نازک با یک برس آغشته شدند و پس از آن در هوای 950 درجه به مدت 4 ساعت تصیف شدند. هه عنوان کاتد استفاده شد. مقدار مورد نظر از Sm2O3 ، SrCO3 و پودر Co3O4 در اتانول با ملات ترکیب شدند و سپس در هوای 1200 به مدت 6 ساعت تصفیه شدند. اکسیدهای La0.6Sr0.4CoO3 ، LaNi0.6Fe0.4O3 ، و La0.8Sr0.2MnO3 نیز با یک واکنش حالت جامد برای مقایسه با اکسید Sm0.5Sr0.5CoO3 تهیه شدند. این خمیرها بر روی سطح دیگر دیسک الکترولیت به شیوه ای مشابه به روش اظهار شده اعمال شدند و سپس در هوای 950 درجه به مدت 4 ساعت تصفیه شدند. یک سیم پلاتین و مش پلاتین به عنوان ترمینال های خروجی و جمع آوری کننده برقی به ترتیب، برای آند نیکل ( SDC )، و یک سیم طلا و مش طلا به طور مشابه برای کاتد Sm0.5Sr0.5Coo3 مورد استفاده قرار گرفتند. سپس این سلول در یک لوله آلومینیوم (آلومینا) ساخته شده (به ترتیب 15 و 19 میلیمتر قطر داخلی و خارجی) قرار داده شد. متان ، اتان، پروپان و LPG با هوا در غلظت 18 ٪ حجم ترکیب شدند به طوری که اکسیداسیون با خیال راحت و بدون انفجار انجام شد. ترکیبی از اتانول و هوا با غلظت اتانول 7.7٪ حجمی نیز با عبور هوا از طریق سیلندر اتانول در 25 درجه آماده شد. این ترکیب گازی در نرخ جریان 300 min21 میلی لیتر بین 350 و 900 درجه تامین شد. این آزمایش های سلول سوختی از طریق اندازه گیری ولتاژ ترمینال بین دو الکترود در مدت تخلیه سلول با استفاده از یک گالوانواستات ( Hokuto Denko با HA -501 ) و با اندازه گیری طیف امپدانس در شرایط مدار باز با استفاده از تجزیه و تحلیل امپدانس ( Solartron SI- 126) انجام شد.
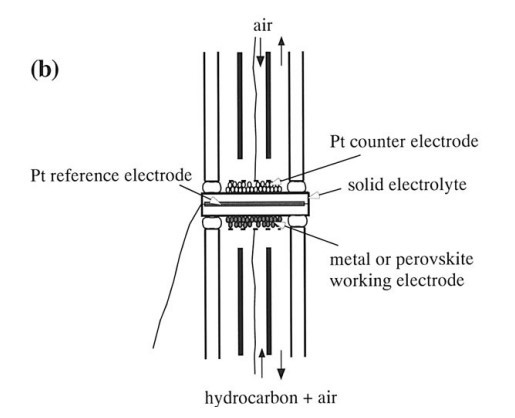
شکل 1b، یک سلول دو-محفظه ای ساخته شده برای اندازه گیری خواص قطبش الکترودهای کاری نیکل (SDC) و Sm0.5Sr0.5CoO3 و فعالیت های کاتالیزوری آنها برای اکسیداسیون هیدروکربن ها را نشان می دهد. این الکترودها روی سطح پایین (منطقه 0.5 سانتی متر مربع) از دیسک الکترولیت به همان شیوه بیان شده قبلی رسوب یافتند. الکترودهای ضد پلاتین و مرجع توسط آغشته نمودن خمیر پلاتین به ترتیب در سطح بالایی ( منطقه 0.5 سانتی متر مربع) و سطح جانبی دیسک الکترولیت رسوب یافتند و پس از آن در 950 درجه به مدت 1 ساعت در هوا تصفیه شدند. دو محفظه گازی با قرار دادن سلول بین دو لوله آلومینیوم (آلومینا) (به ترتیب، 9 و 13 میلیمتر قطر داخلی و بیرونی ،) تنظیم شدند. هر محفظه توسط ذوب نمودن یک حلقه شیشه ای در اتصال لوله و الکترولیت در 950 درجه مهر و موم شد. محفظه کاری با ترکیب گاز مشابه در نرخ جریان توصیف شده گذشته به اندازه 300 min21 میلی لیتر بین 450 و 950 درجه تامین شد. الکترودهای شمارنده و مرجع در معرض هوا قرار گرفتند. پتانسیل بیش از حد آندی یا کاتدی که پتانسیل اهمی عاری از تلفات است، از الکترود کاری توسط یک ژنراتور پالس جریان ( Nikko در Keisoku NCPG -101 ) اندازه گیری شد که در آن صعود و نزول 2 میکرو ثانیه با دقت 60.01 ٪ بود اندازه گیری شد. تجزیه و تحلیل گاز خروجی از محفظه کاری به صورت خشک با استفاده از کروماتوگرافی آنلاین گازی ( Schimazu GC- 8A ) انجام شد. جداسازی متان ، اکسیژن، هیدروژن و مونوکسید کربن با استفاده از ستون 5A غربال مولکولی در 50 درجه انجام شد ، و دیگران با استفاده از ستون Porapak Q در 50 درجه تجزیه و تحلیل شدند.
نتایج و بحث
عملکرد سلول در ترکیب سیال متان و هوا. - شکل 2 نشان دهنده منحنی های قطبش چهار الکترود فلزی مشغول به کار در سلول دو-محفظه ای (شکل B1) با استفاده از LSGM به عنوان الکترولیت در یک ترکیب سیال متان و هوا در 700 درجه است. پتانسیل های الکترود فلزی تحت شرایط مدار باز، -1000 میلی ولت برای نیکل (SDC)، -992 میلی ولت برای نیکل، -793 برای پلاتین و -7 میلی ولت برای پلاتین بود. همانطور که می توان از جدول 1 دید، که در آن ترکیباتی از گازهای خروجی از این الکترودها به صورت خلاصه دیده می شود، متان با هیدروژن، مونوکسید کربن و دی اکسید کربن در سه الکترود اول اکسیده شده است، در حالی که میزان اکسیداسیون متان بیش از حد کند بود تا بتواند در الکترود پلاتین اندازه گیری شود. علاوه بر این، مقادیر هیدروژن و مونوکسید کربن تشکیل شده در مرتبه نیکل ( SDC ) نیکل > PD، ( ) بودند که مربوط به روند پتانسیل است. این نتایج نشان می دهد که واکنش های زیر در الکترودهای کاری نیکل ( SDC ) ، نیکل و Pd انجام می شوند.
The performance of a single-chamber solid oxide fuel cell (SOFC) was studied between 350 and 9008C in flowing mixtures of methane, ethane, propane, or liquefied petroleum gas and air with a fuel/air volume ratio of one, where their oxidation proceeded safely without explosion. Among all tested electrode materials, Ni-Ce0.8Sm0.2O1.9 cermet and Sm0.5Sr0.5CoO3 oxide functioned best as the anode and cathode, respectively, in various gas mixtures. A cell constructed from a La0.9Sr0.1Ga0.8Mg0.2O3 electrolyte with the two electrodes generated >900 mV in a methane-air mixture between 600 and 8008C and in an ethane-air mixture between 450 and 6508C. A small electrode reaction resistance resulted in increasing power density with decreasing electrolyte thickness. The peak power density at 4508C increased from 34 to 101 mW cm22 with decreasing electrolyte thickness from 0.50 to 0.18 mm. The working mechanism of the single-chamber SOFC at different temperatures was also studied by measuring the catalytic activities of the two electrodes for partial oxidation of the hydrocarbons.
There is worldwide interest in the development and commercialization of fuel cells for vehicles and portable electric devices. It is a presently accepted notion that polymer electrolyte fuel cells (PEFCs) are the only devices capable of operating at low temperatures. We believe, however, that PEFCs are not perfect from a practical point of view because they require hydrogen as the fuel, which is impractical in terms of storage and handling. An external reformer, therefore, must be used to convert more viable alcohols and hydrocarbons into hydrogen, thereby defeating their portability. There have been recent successes with solid oxide fuel cells (SOFCs) which perform well between 500 and 7008C directly using alcohols and hydrocarbons as the fuels.1-3 A further reduction in the operating temperature of internal-reforming SOFCs and an enhancement of their thermal- and mechanical-shock resistance would make this technology a promising alternative to PEFCs.
A novel type of fuel cell, which is distinguished from conventional fuel cells in design and principle, has been proposed by many researchers.4-8 This fuel cell consists of only one gas chamber, where both the anode and the cathode are exposed to the same mixture of fuel and air. We will use a single-chamber fuel cell (SCFC) as a notation for this type of fuel cell. Because there is no need to separate the supply of fuel and air, it is more thermally and mechanically shock resistant than conventional fuel cells. We have recently succeeded in applying this cell design to an SOFC constructed from an yttria-stabilized zirconia (YSZ) electrolyte with a Ni-based anode and a strontium-doped lanthanum manganite (LSM) cathode.9 This SCFC exhibits high power density in a flowing mixture of methane and air, but it must operate at the high temperature of 9508C in order to achieve sufficient ionic conduction in the solid electrolyte.
ive ohmic and polarization losses in the cell. Thus, it is necessary to use a highly conductive electrolyte together with a highly active anode and cathode. Lanthanum gallate-10-14 or ceria-based15-18 oxides would be promising electrolytes because of their much higher ionic conductivities than that of YSZ. In addition, Ni-ceria cermets19 and Co-based perovskite oxides,20,21 which exhibit mixed ionic and electronic conduction under each of their respective operating conditions, have been generally regarded as suitable anodes and cathodes, respectively, at reduced temperatures.
In this study, we demonstrate that it is possible to operate a thermally and mechanically shock-resistant SOFC at reduced temperatures by combining the advantages of using a highly conductive electrolyte with the single-chamber cell design. We also show that ethane, propane, and liquefied petroleum gas (LPG) can be successfully used as the fuels in the present SCFC, especially at operating temperatures below 5508C.
Experimental
Figure 1a shows an SCFC constructed for fuel-cell tests at reduced temperatures. La0.9Sr0.1Ga0.8Mg0.2O3 (LSGM),
Ce0.8Sm0.2O1.9 (SDC), and YSZ (8 mol % yttria) were used as the electrolytes. Both LSGM and SDC were prepared by pressing their commercial ceramic powders (Anan Kasei) hydrostatically into pellets at 2 3 103 kg cm22 and then sintering in air at 15008C for 10 h. After the pellet was cut into a disk (ca. 14 mm diam, ca. 3 mm thick) with a diamond cutter, the disk surface was polished to a given thickness (0.18-0.50 mm) with an abrasive paper. The sintered YSZ disk (14 mm diam, 0.5 mm thick) was purchased from Sumitomo Osaka Cement. Unless otherwise stated, the 0.5 mm thick electrolyte was used as the test specimen.
10 wt % SDC-containing Ni [Ni (SDC)] metal was used as the anode. NiO powder (Kojundo Chemical Laboratory) was mixed with the SDC powder in ethyl carbitol and then ground with a zirconia mill container and zirconia grinding balls for 1 h. Ni, Pd, and Pt metals were also used as the anodes for comparison. These pastes were smeared on one surface (0.5 cm2 area) of the electrolyte disk as thinly as possible with a brush, followed by calcining in air at 9508C for 4 h. Sm0.5Sr0.5CoO3 was used as the cathode. The desired amounts of Sm2O3, SrCO3, and Co3O4 powders were mixed in ethanol with a mortar and a pestle and then calcined in air at 12008C for 6 h. La0.6Sr0.4CoO3, LaNi0.6Fe0.4O3, and La0.8Sr0.2MnO3 oxides were also prepared by a solid-state reaction, for comparison with the Sm0.5Sr0.5CoO3 oxide. These pastes were applied on another face of the electrolyte disk in a manner similar to that stated and then calcined in air at 9508C for 4 h. A Pt wire and a Pt mesh were used as the output terminal and the electrical collector, respectively, for the Ni (SDC) anode, and a Au wire and a Au mesh were similarly used for the Sm0.5Sr0.5Coo3 cathode. The cell thus fabricated was placed in an alumina tube (15 and 19 mm inner and outer diameters, respectively). Methane, ethane, propane, and LPG were mixed with air to a concentration of 18 vol % so that the oxidation would proceed safely without explosion. A mixture of ethanol and air with an ethanol concentration of 7.7 vol % was also prepared by passing air through an ethanol bubbler at 258C. The gas mixture was supplied to the cell at flow rates of 300 mL min21 between 350 and 9008C. The fuel-cell tests were carried out by measuring the terminal voltage between the two electrodes during cell discharge using a galvanostat (Hokuto Denko HA-501) and by measuring the impedance spectrum under open-circuit conditions using an impedance analyzer (Solartron SI-1260).
Figure 1b shows a two-chamber cell constructed for the measurement of the polarization properties of the Ni (SDC) and Sm0.5Sr0.5CoO3 working electrodes and their catalytic activities for the oxidation of hydrocarbons. These electrodes were deposited on the bottom surface (0.5 cm2 area) of the electrolyte disk in the same manner as stated previously. Pt counter and reference electrodes were deposited by smearing the Pt paste on the top surface (0.5 cm2 area) and the side surface of the electrolyte disk, respectively, and then calcining at 9508C for 1 h in air. Two gas chambers were set up by placing the cell between two alumina tubes (9 and 13 mm inner and outer diameters, respectively). Each chamber was sealed by melting a glass ring gasket at the joint of the tube and the electrolyte at 9508C. The working chamber was supplied with the same gas mixture described previously at a flow rate of 300 mL min21 between 450 and 9508C. The counter and reference electrodes were exposed to atmospheric air. The anodic or cathodic overpotential, which is the ohmic lossfree potential, of the working electrode was measured by a currentpulse generator (Nikko Keisoku NCPG-101), where the rise and fall times were 2 ms with a precision of 60.01%. The analysis of the outlet gas from the working chamber was performed on a dry basis using on-line gas chromatography (Schimazu GC-8A). The separation of methane, oxygen, hydrogen, and carbon monoxide was performed using a molecular sieve 5A column at 508C, and the others were analyzed using a Porapak Q column at 508C.
Results and Discussion
Cell performance in a flowing mixture of methane and air.—Figure 2 shows the polarization curves of the four metal working electrodes in the two-chamber cell (Fig. 1b) using LSGM as the electrolyte in a flowing mixture of methane and air at 7008C. The potentials of the metal electrodes under open-circuit conditions were 21000 mV for Ni (SDC), 2992 mV for Ni, 2793 mV for Pd, and 27 mV for Pt. As can be seen from Table I, where the compositions of the outlet gases from these electrodes are summarized, methane was oxidized to hydrogen, carbon monoxide, and carbon dioxide at the first three electrodes, whereas the oxidation rate of methane was too slow to be measured at th Pt electrode. In addition, the amounts of hydrogen and carbon monoxide formed were in the order Ni (SDC) > Ni > Pd, which corresponds to the potential trend. These results indicate that the following reactions proceed at the Ni (SDC), Ni, and Pd working electrodes
آزمایشی
نتایج و بحث
نتایج
Experimental
Results and Discussion
Conclusions
References
