
دانلود رایگان مقاله ویژگی های بیومکانیکی ایمپلنت دندانی با بارگذاری فوری
چکیده
این مطالعه با هدف مقایسه ویژگیهای ایمپلنتهای دندانی بیومکانیک بلافاصله بارگذاریشونده (OS) که روی شاخ گوزن کوهی سیکا جایگذاری شده و پایهای برای ساخت یک مدل حیوانی جایگزین برای مطالعات ایمپلنتهای دندانی، صورت گرفته است. در هر شاخ دو ایمپلنت قرار داده شد. یکی از ایمپلنتها که بلافاصله بارگذاری شد؛ توسط دستگاه بارگذاری ساخته شده بود و ایمپلنت دیگر با دستگاه کنترل بارگیری شد، بعد تخلیه شد. ایمپلنتهای IL بعد از دورههای مختلف بارگذاری برداشته شدند. پس از اینکه شاخ ریخت، ایمپلنتهای تخلیه شده (OS) برداشت شد. با اسکنر میکروتوموگرافی نمونهها اسکن شدند و مدلهای عنصر تا حدودی تولید شدند. روی ایمپلنت نیروی عمودی 10 نیوتن اعمال شد. مقایسهای بین میانگین مقادیر حداکثر جابجایی، تنش و رویهها انجام شد. نتایج نشان داد افزایش زمان بارگذاری، باعث افزایش قابل توجه چگالی بافت شاخ در اطراف ایمپلنت میشود. پس از ریختن شاخ، 3 جفت شاخ کوچک (شاخسار) از شاخهای گوزن جمعآوری شد و تراکم بافت شاخ در تمام نمونهها با ارزش مشابهی باقی ماند. حداکثر مقادیر جابجایی و تنش در ایمپلنت و تنش و سویههای بافت شاخ در مدلهای OS کاملا متفاوت بودند. به طور معنیدار تمام پارامترهای بیومکانیکی مدل IL در یک شاخ، بیشتر از مدل OS به مدل حیوانی شبیه بود و باعث توزیع وسیعی از مدل IL شده بود. میتوان نتیجه گرفت ایمپلنتهای وارد شده به شاخ گوزن سیکا، روند رشد و استخوانی شدن فرایند شاخ را از بین نمیبرد و استفاده از مدل شاخ گوزن سیکا یک جایگزین امیدوارکننده برای مطالعات ایمپلنت است که نیازی به قربانی شدن حیوانات ندارد.
1. معرفی
با رشد جمعیت پیرامون جهان، در چند دهه گذشته، تقاضا برای جایگزینی دندانهای از دست رفته با استفاده از ترمیمهای ایمپلنت حفظشده، افزایش چشمگیری یافته است. موفقیت بالینی درمان ایمپلنت بر پایه ایمپلنت ادغامی میباشد، که به عنوان ارتباط مستقیم بین استخوان زنده و ایمپلنت بدون تعامل با بافت فیبرینی تعریف شده است[1-3]. به طور متعارف، بارگذاری روی بازسازی ایمپلنت حفظ شده باید قبل از تبدیل به استخوان انجام شود. با این حال، بارگذاری بلافاصله ایمپلنتها (IL) باعث کوتاهتر شدن زمانهای بهبودی میشود و نشان دهنده ایمنی پایدار و میزان موفقیت ایمپلنت در مقایسه با بارگذاری ایمپلنتهای تاخیری است. بعضی از مطالعات نشان داد که IL برای بارگذاری تاخیری مفید است، زیرا بارگذاری قادر به تحریک روند بهبودی است [4 -6]. به نظر میرسد ایمپلنتهای IL رضایت بیمار را افزایش دهند و از سختی استفاده از بازسازی موقت در فاز بهبودی نیز اجتناب کنند [7]. بنابراین، در حال حاضر روند استفاده از پروتکل بارگذاری فوری برای بازسازی ایمپلنت حفظ شده است.
در حالی که مدلهای حیوانی به طور دقیق وضعیت بالینی مکانیکی و فیزیولوژیکی بالینی را نشان میدهند؛ آنها در تحقیقات ایمپلنتهای دندانی در موقعیتهای بارگیری یا تخلیه به این دستآورد رسیدند که ایمپلنتها بیش از حد قوی و طولانی مدت هستند و با کیفیتهای مختلف بافت (مثلا استخوان نرمال سالم یا پوکی استخوان) و در سنین مختلف قابل استفاده میباشند [8 ]. هر مدل میتواند عامل مزایا و معایب منحصر به فردی باشد؛ بنابراین برای اهداف مختلف، مدلهای متعددی برای آزمایش خصوصیات ایمپلنت و بافت اطراف آن در داخل وجود دارد. بالاخص، برای مطالعات انجام شده در مورد روند بازسازی استخوان در اطراف ایمپلنتهای اپیلاسیون، مدل حیوانی باید دارای ویژگیهای استخوانی مشابه با استخوان انسان باشد و مناسب برای قرار دادن ایمپلنتها و اعمال بارگذاری باشد. با این حال، معایب اصلی برای مدلهای موجود، بارهای کنترل نشده هستند که بر روی ایمپلنتها و سرنوشت فداکار حیوانات اعمال میشود. به همین علت، استفاده از یک مدل حیوانی جدید که قادر به اعمال نیروی کنترل شده بر روی ایمپلنت وارد شده IL است و با رفتار حیوانات تداخل نداشته باشد قابل تحسین خواهد بود.
گوزنها تنها پستاندارانی هستند که توانایی کامل احیاء یک عضو پیچیده را دارند. توانایی احیای دوباره به طور کامل ایجاد میشود. بازسازی تکراری شاخهای گوزن یکبار در هر سال و یا بیشتر به عنوان یکی از ویژگیهای قابل توجه است، زیرا پستانداران پدیدههایی هستند که به طور کلی به عنوان ناتوان در بازسازی شناخته میشوند. رشد سالیانه شاخ و برگ گوزنها به عنوان چیزی که در برابر قانون طبیعت نقش دارد در نظر گرفته میشود. [11]. فصل بهار آغاز چرخه سالانه رشد شاخها میباشد. پس از انقباض سریع و شکلگیری شاخههای جانبی در تابستان، شاخها به تدریج در اواخر تابستان یا پاییز استخوانی میشوند. فرآیند استخوانی شدن همراه با از دست دادن عروق خونی و اعصاب و ریخته شدن پوست مخملی اتفاق میافتد. در زمستان، شاخسارههای استخوانی که بیحس هستند به طور قاطعانه به پایه ساقه متصل می شوند و برای تجدید قوام، تا بهار، شاخها یک دور دیگر شروع به «ریزش» میکنند. [12]. این چرخه طول عمر مناسب را برای بررسی پروسههای بازسازی استخوان در اطراف ایمپلنتهای داخل شاخ بدون به خطر انداختن حیوان فراهم می کند. علاوه بر این، شاخسارههای گوزن نسبت به ترکیبات شیمیایی و ساختار فیزیولوژیکی شبیه به استخوانهای انسانی هستند [13، 14]. علاوه بر این، به عنوان یک افزودنی جمجمه مفصلی استخوانی عضلانی و مفصل [15، 16]، یک مدل جذاب برای بررسی روند بازسازی استخوان در اطراف ایمپلنت IL بدون تاثیر نیروهای خارجی (به جز گرانش) ارائه میدهد.
هدف اصلی این مطالعه، مقایسه ویژگیهای بازسازی استخوان و ویژگیهای بیومکانیک ایمپلنتهای بلافاصله بارگذاری شده و ایمپلنت ادغامی دندان است که در شاخ گوزن قرار گرفتهاند. ثانیا، هدف این بود که پایهای نظری برای ایجاد یک مدل حیوانات جایگزین برای مطالعه بازسازی استخوان در سراسر ایمپلنتهای دندانی داشته باشیم.
2. مواد و روشها
1-2- بیانیه رفاه حیوانات
همه حیوانات طبق سیاستها و دستورالعملهایی قرار میگیرند که توسط قانون رفاه حیوانات آلمان (TSchG، آخرین اصلاح شده در تاریخ 3 دسامبر 2015)، نوشته شده که آنها توسط اداره دولتی منطقه حفاظت از طبیعت، محیط زیست و مصرف کنندگان نروژ به عنوان مقام صلاحیتدار هستند.
2-2- روش جراحی
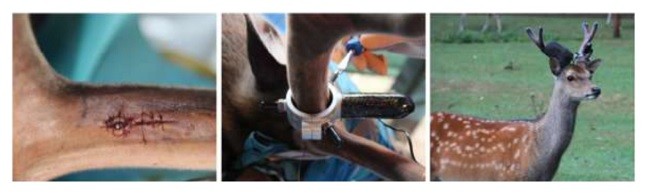
در ماه ژوئیه سال جاری، شش گوزن 4 ساله نر سیکا را (در حیاتوحش پارک هلدنال، آلمان) با استفاده از میلی لیتر در مخلوط هلابران (100 میلیگرم کتامین و 125 میلیگرم زایلازین در هر میلیلیتر) بیهوش کردند. بیهوشی با توجه به روشهای استاندارد [17، 18] پس از ضدعفونی کردن و بیحسی موضعی اضافی با لیدوكائین 3-5 میلی لیتر (لیدوکائین ب. برآین 2% ب. برآین میلسانگین، میلسانگین، آلمانی) انجام شد. با انجام برش طولی و عرضی فلپ مخملی افزایش یافت. براساس پروتکل جراحی سایت ایمپلنت، در موقعیتی در نزدیکی شاخهای از گوزن، توسط حفرههای متوالی به روش آبیاری استریل سالینی تهیه شد. در هر شاخ دو ایمپلنت در فاصله 5/2 سانتیمتر و ایمپلنتهای ایمپلنت بافت (موسسه استراومن، ایجی، بازل، سوئیس) با طول 10 میلیمتر و قطر 3/3 میلیمتر قرار داده شد. پس از دوختن برش، پروگزیمال ایمپلنت به طور عمودی از طریق یک دستگاه خودساختهشده قفلشده، [19] بارگذاری شد، در حالی که شاخهای دیگر که تحت دستگاه کنترل بودند، بارگیری نشدند. بر روی شاخهای دیگر، موتور کنترل الکترونیکی توسط باندهای رنگی ثابت شد. برای تشخیص حیوانات، تارهای با رنگهای مختلف، آبی، نارنجی، زرد، قرمز و سیاه استفاده شد (شکل 1). در طی فاز دندانی یک گوزن جان سالم به در برد. بعد از 2، 3، 4، 5 و 6 هفته، ایمپلنتهای بارگذاری شده و بافتهای اطراف به صورت تصادفی با یک تریپین از یک حیوان برداشته شد و زخمها با موم استخوانی (موم استخوان اتیکون، جانسون و جانسون، هامبورگ، آلمان)، بخیه و باند محافظت شدند. در فرمالین بافر (4%) نمونهها ثابت ماندند. به علت استخوانیشدن، ایمپلنتهای تخلیه شده در شاخ، باقی مانده بودند. در فصل زمستان، شاخسارهها پس از فرو ریختن جمعآوری شدند. در نهایت جمعآوری تنها سه جفت زرد، آبی، نارنجی و سیاه انجام شد. از زنجیرها دو جفت دیگر پیدا نشدند. بعداً به همراه نمونه اولیه، ایمپلنت بدون بارگذاری با بافت اطراف شاخ و بافت شاخ، را برای تحقیق بیشتر در بخشهای مختلف قرار دادند.
3-2- تحلیل عددی
نمونهها در یک اسکنر میکروتوموگرافی (اسکایاسکن 1174، میکروبروکسیتی، کُنتیک، بلژیک) تهیه و اسکن شدند و با استفاده از 50 کیلو و 800 مگا وات، مرحله چرخش 25/0 درجه انجام شد. مجموعه دادهها بازسازی شدند. بعد از اسکن نمونه، فانتوم کالیبراسیون با تراکم شناخته شده هیدروکسی آپاتیت کلسیم (اسکایاسکن 1174، میکروبروکسیتی، کُنتیک، بلژیک) در همان روز با استفاده از پارامترهای مشابه اسکن شد. سنجش تراکم استخوان (BMD) بافت شاخ (از جمله استخوان کورتیک و تربوکولر) با استفاده از (میکروبروکرسیتی، کُنتیک، بلژیک) محاسبه شد.
Abstract
This study aimed to compare biomechanical characteristics of immediately loaded (IL) and osseointegrated (OS) dental implants inserted into Sika deer antler and lay a foundation for developing an alternative animal model for dental implants studies. Two implants per antler were inserted. One implant was loaded immediately via a self-developed loading device; the other was submerged and unloaded as control. IL implants were harvested after different loading periods. The unloaded implants were collected after OS and the shedding of antler. Specimens were scanned by μCT scanner and finite element models were generated. A vertical force of 10 N was applied on the implant. The mean values of maximum displacements, stresses and strains were compared. The results showed that the density of antler tissue around the implants dramatically increased as the loading time increased. After shedding the antler, 3 pairs of antlers were collected and the density of antler tissue remained in a similar value in all specimens. The maximum values of displacement and stresses in implant and stresses and strains in antler tissue were significantly different among OS models. In one antler, all the biomechanical parameters of IL model were significantly higher than those of OS model of the same animal (P < 0.05) and wider distributions were obtained from IL model. It can be concluded that implants inserted into Sika deer antler might not disturb the growth and calcification process of antler and the use of Sika deer antler model is a promising alternative for implant studies that does not require animal sacrifice.
1. Introduction
With the worldwide growing of aging population, there has been considerable increase in the demand for the replacement of lost teeth by means of implant-retained restorations over the last few decades. The clinical success of implant therapy is based on osseointegration, defined as the direct contact between living bone and the implant without the interposition of fibrous tissue [1–3]. Conventionally, loading on implant-retained restoration should be avoided before osseointegration. However, immediately loaded (IL) implants which allow for shorter rehabilitation times have shown similar implant stability and success rate compared with traditional delayed loading implants. Some studies showed that IL is beneficial to delayed loading, since loading is capable of stimulating the healing process [4–6]. IL implants appear to increase patient satisfaction and avoid the difficulty of wearing a conventional temporary restoration during the healing phase as well [7]. Thus, there is a trend in using an immediate loading protocol for implant-retained restoration currently.
While animal models closely represent the mechanical and physiological human clinical situation, they have been widely used in investigating dental implants in loaded or unloaded situations over potentially long time spans and in different tissue qualities (e.g., normal healthy or osteoporotic bone) and ages [8]. Each animal model has unique advantages and disadvantages; therefore for different purposes there are numerous models for testing the properties of implant and its surrounding tissue in vivo. Specifically, for studies investigating bone remodeling process around IL implants, the animal model should have similar bone characteristics to human bone and be appropriate for inserting implants and applying loadings [9]. However, the main disadvantages for the existing animal models are the uncontrolled loads that are exerted on the implants and the sacrificed fate of animals. For these reasons, exploring a novel animal model that is able to apply a controlled force on the inserted IL implant and does not interfere with the animals’ behavior is admirable.
Deer are the only mammals that are capable of fully regenerating a complex organ, called antlers [10]. The ability to fully regenerate stands out as the most impressive feature of antlers. The repeated regeneration each year is even more remarkable, because mammalian appendages are generally considered as being incapable of regeneration. Deer antlers grow annually in defiance of what could be considered nature’s rules [11]. The annual cycle of antler growth starts in spring. After the rapid elongation and the formation of lateral branches in summer, antler gradually becomes calcified in late summer or autumn. The process of calcification is initiated from the base of the antler and proceeds up through the antler and finishes when the distal ends of the tines form sharp tips [11]. After the calcification process has been completed, in conjunction with the loss of blood vessels and nerves, the velvet skin is shed. In winter, the bare bony antlers are firmly attached to the living pedicle and are not “cast” until the following spring. Antler casting triggers another round of antler regeneration [12]. This cycle provides a relative reasonable time span for investigating bone remodeling processes around implants inserted into the antler without sacrificing the animal. Besides, deer antlers are similar to human bones in regard to chemical composition and physiological structure [13,14]. Furthermore, as a muscle- and joint-free bony cranial appendage [15,16], antlers provide a fascinating model to investigate bone remodeling process around IL implant without the influence of external forces (except for gravity).
The primary aim of this study was to compare bone remodeling and biomechanical characteristics of immediately loaded and osseointegrated dental implants inserted into Sika deer antler. Secondly, the aim was to lay a theoretical foundation for developing an alternative animal model for studying bone remodelling around dental implants.
2. Materials and methods
2.1. Animal welfare statement
All animals were handled according to the policies and principles established by the German animal welfare act (TSchG, last amended on 3rd December 2015), approved by the North RhineWestphalia State Agency for Nature, Environment and Consumer Protection as competent authority (Permission No.: LANUV NRW, 84-02.04.2014.A462).
2.2. Surgery procedure
In July of 2015, six 4-year-old male Sika deer (bred at Wildlife Parc Hellenthal, Germany) were anesthetized using 1.2–1.5 ml Hellabrunn’s mixture (100 mg Ketamine and 125 mg Xylazine per ml) according to standard procedures [17,18]. After disinfection and additional local anaesthesia with 3–5 ml lidocaine (Lidocain B. Braun 2%, B. Braun Melsungen, Melsungen, Germany), a longitudinal incision was performed and velvet flap elevated. Implant site was prepared at a position near a branching of the antler by sequential drilling under sterile saline irrigation according to the surgical protocol. Two implants per antler were inserted in a distance of 2.5 cm. The implants were Straumann Roxolid® soft tissue level implants (Institut Straumann AG, Basel, Switzerland) with a length of 10 mm and a diameter of 3.3 mm. After suturing the incision, the most proximal implant was vertically loaded immediately via a self-developed screw retained loading device [19], while the other one remained unloaded as a control. The motor of the control electronics were fixed on the other antler by colored bandages. Bandage with the different colors, blue, orange, yellow, red and black were used to distinguish the animals (Fig. 1). One deer was dead during the anesthetisation phase. After 2, 3, 4, 5 and 6 weeks, respectively, the loaded implants and surrounding tissue were randomly taken out with a trephine from one animal and the wounds were filled with bone wax (Ethicon®-bone wax, Johnson and Johnson, Hamburg, Germany), sutured and bandage protected. The samples were fixed in buffered formalin (4%). The unloaded implants remained in the antler for osseointegration. In winter, the antlers were collected after their shedding. Finally only three pairs of antlers, blue, orange and black, were able to be collected. The other two pairs of antlers could not be found. Thereafter, the unloaded implant with surrounding antler tissue and the antler tissue adjacent to the former specimen were sectioned for further investigation.
2.3. Numerical analysis
Specimens were prepared and scanned in a μCT scanner (SkyScan 1174, Bruker-micro CT, Kontich, Belgium) using 50 kV and 800 μA, rotation step of 0.25°. Data sets were reconstructed. After scanning the sample, calibration phantom with known density of calcium hydroxyapatite (SkyScan 1174, Bruker-microCT, Kontich, Belgium) was scanned on the same day by using the same parameters. Bone mineral density (BMD) of antler tissue (including cortical and trabecular bone) was calculated by using Bruker-Micro CTAnalyser (Bruker-micro CT, Kontich, Belgium).
چکیده
1. معرفی
2. مواد و روش ها
1-2- بیانیه رفاه حیوانات
2-2- روش جراحی
3-2- تحلیل عددی
4-2- ارزیابی آماری
3. نتایج
1-3- تراکم استخوان و مدول یانگ از بافت شاخ
2-3- نتایج FE
4. بحث
5. نتیجهگیری ها
Abstract
1. Introduction
2. Materials and methods
2.1. Animal welfare statement
2.2. Surgery procedure
2.3. Numerical analysis
2.4. Statistical evaluation
3. Results
3.1. BMD and Young's modulus of the antler tissue
3.2. FE results
4. Discussion
5. Conclusions
