
دانلود رایگان مقاله نسبت منبع بر متابولیسم فتوسنتزی برگهای منبع
چکیده
زمانیکه هفت گونه از غلات تحت شرایط زیست محیطی یکسان کشت شدند، کاهش نسبت مخزن به منبع منجر به کاهش میزان فتوسنتز در عرض 1 الی 3 روز در گونه های Cucumis sativus L، Gessypium hirsutum L و Raphanus sativus L. گردید ولی در گونه های Cupsicum annuum L. ، Solanum melongena L. ، Phaseolus vulgaris L. یا Ricinus communis L. چنین نبود. این کاهش به بستن روزنه ارتباطی نداشت. در گیاه پنبه و خیار، حذف مخزن منجر به افزایش میزان نشاسته و قند، در ذخایر گلوکز 6-فسفات و فروکتوز-6 فسفات گردید و نیز منجر به افزایش در نسبت 14C شناسایی شده در فسفات های قندی و UDP گلوکز پس از تامین 14CO2 گردید. زمانیکه مانوز در اختیار دیسک های برگی قرار گرفت تا با فسفات غیرآلی سیتوپلاسمی تشکیل کمپلکس دهد، تحریک سنتز نشاسته، و مهار تثبیت CO2، در دیسک های شاهد مشاهده گردید اما در دیسک های گرفته شده از گیاهان تحت آزمایش چنین نبود. بافر فسفات باعث کاهش سنتز نشاسته در گیاهان تحت آزمایش گردید ولی نه در دیسک های شاهد چنین نبود. این یافته ها نشان می دهد که حذف مخزن منجر به میزان کاهش یافته ای از فسفات غیرآلی به ترکیبات فسفریله می گردد. در لوبیا کربن 14C در فسفات های قندی بعد از حذف مخزن افزایش یافت ولی بدون تجمع سوکروز چنین گردید که نشانگر کنترل شدیدتر میزان قند در حالت بازخورد بود. نشاسته به میزان بالاتر از بقیه گیاهان تجمع یافت ولی میزان تثبیت CO2 برای چندین روزثابت بود.
مشاهده شده است که تقاضای تغییر یافته مخزن یافته منجر به تغییر میزان فتوسنتز برگ منبع در تعدادی از گونه ها شده است. مکانیسمی که طی آن شرایط مخزن به منبع انتقال می یابد هنوز روشن نیست. همچنین، در برخی تحقیقات تعامل مخزن به منبع چندان قابل شناسایی نبوده است. برخی از نتایج ضد و نقیض در متون علمی را می توان ناشی از تفاوتهای موجود میان شرایط رشد و روش آزمایش در ازمایشگاه های مختلف دانست. سایر موارد را می توان به تفاوتها در پاسخ های میان گونه های مختلف نسبت داد. ما تحقیقی را درباره اثر روشهایی اجرا کردیم که میزان جابجایی را طبق فعالیتهای متابولیک برگهای منبع در چندین گونه گیاه پرورش یافته تحت شرایط زیست محیطی کنترل شده یکسانی تغییر می دهند. اخیرا دو اثر قابل مشاهده را در گیاه خیار بعد از عملیات حلقه یا حذف مخزن گزارش کردیم. یک اثر کوتاه مدت بعد از 3 ساعت با جبران متعاقب به حد ماکزیمم رسید، و شامل بستن روزنه احتمالا بدلیل تحریک با افزایش موقتی استرس آب برگ و میزان ABA، بدون تغییرقابل شناسایی در الگوی ترکیب کربن 14C با متابولیت ها بوده است. یک اثر طولانی مدت بعد از 3 روز شناسایی گردید و شامل تغییراتی در مقدار نسبی کربن 14C ترکیبی با انواع محصولات فتوسنتزی و ترکیبات واسطه بود، ولی به پاسخ های روزنه ارتباطی نداشت. در این مقاله اثرات درازمدت متابولیسم مخزن را در تعدادی گونه های دیگر گزارش می دهیم و درباره این یافته ها در رابطه با ماهیت احتمالی پیامی که انتقال دهنده تقاضای مخزن برای فعالیت منبع می باشد، بحث می کنیم.
مواد و روشها
گیاهان پنبه (Gossypium hisutum L. cv Acala Sj-2)، لوبیا (Phaseolus vulgaris L. cv Bulgarian)، خیار (Cucumis sativus L. cv Dalila)، تربچه (Raphanus sativus L. cv Munchner Bierrettich)، فلفل سبز (Capsicum annum L. cv California Wonder)، بادمجان (Solanum melongena L. cv Black Beauty) و کرچک (Ricinus communis L.) در یک ظرف پلاستیکی استوانه ای 2 لیتری مملو از ورمی کولیت پرورش یافتند. گیاهان به صورت یک گیاه در هر گلدان مدت کوتاهی بعد از پدیدار شدن هرس گردیدند و دو بار در هفته با آب دیونیزه آبیاری شدند و یک بار در هفته با محلول Hoagland نیمه قوی آبیاری شدند. آب و محلول اضافی از ته ظرف تخلیه گردید. همه گونه ها در یک اتاقک که با حفظ دمای 25درجه سانتیگراد با چگالی شار کوانتومی 450 µmol m-2 s-1 (400 الی 700 نانومتر) و یک دوره نوری 13 ساعته و تاریکی 11 ساعته رشد نمودند.
آزمایشات با گیاه پنبه حدود 10 روز بعد از پدیداری اولین گل (11 الی 12 هفته بعد از پدیداری خود گیاه) اجرا گردیدند. گیاهان لوبیا در مرحله اولین برگ جوانه زده کاملا پهن شده استفاده گردیدند (22 الی25 روز بعد از پدیداری خود گیاه).
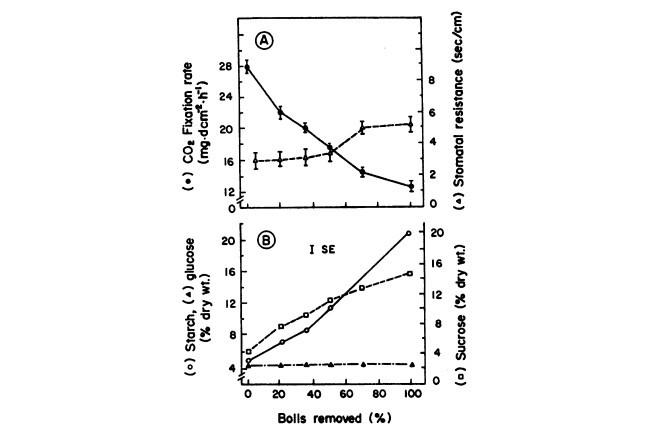
یک آزمایش با گیاه پنبه (شکل 1) روی گیاهان پرورش یافته در مزرعه اجرا گردید، گیاه پنبه در 25 می در ردیفهای 1 متر جدا از هم کشت شد و بعد از پدیداری گیاه به تعداد 10 گیاه در هر متر مربع هرس گردید. بعد از نورافشانی برای اطمینان از پدیداری گیاه، یک سیستم آبیاری قطره ای نصب گردید. برگهای جانبی کنار ردیف های گیاهان واقع گردیدند و نورافشانها 40 سانتی متر از هم فاصله داشتند. گیاهان یک بار در روز آبیاری شدند و مقدار آب تامینی براساس تبخیر از یک ماهیتابه رده A تعیین گردید. نوترینتهای حاوی اوره، H3PO4 و KCl در نسبت N:P:K برابر با 4:1:2 در آب آبیاری با غلظت 80g×m-3 از قبل حل گردیدند. گیاهان برای این آزمایش در روز 12 آگوست استفاده گردیدند، یعنی زمانیکه حدود 10 غوزه پنبه یا گل در هر گیاه وجود داشت.
مخزن حذف شده در مورد گیاه پنبه پرورش یافته در اتاقک رشد شامل اولین غوزه پنبه در حال رشد بود و اندازه گیریها روی برگ بالغ در مجاورت این غوزه پنبه صورت گرفت. در پنبه رشد کرده در مزرعه، انواع تعداد غوزه ها یا گلها حذف گردید، و اندازه گیریها روی چهار برگ با سنین مختلف در طول محور گیاهان اجرا گردید. عصاره های اینها با هم ترکیب گردید. در مورد گیاهان لوبیا، مخزن حذف شده شامل دومین برگ جوان در حال رشد در سه برگچه و غنچه های در حال رشد بود. اولین برگ در سه برگچه به عنوان برگ منبع درنظرگرفته شد.
میزان تثبیت CO2 در مساحت های دایره ای 5/1 سانتیمتر مربعی از برگهای متصل طبق عملیاتی که در مقاله قبلی (12) شرح داده شد، اندازه گیری گردید.
این قسمتها در یک میکرواتاقک دربسته قرار گرفتند و در معرض جریان هوای حاوی 300µl L-1 14CO2+12CO2 به مدت 60 ثانیه قرار گرفتند. مواد محلول اتانولی و مواد محلول HCIO4 طبق مقاله Mayoral و همکارانش (17) تعیین شدند. مواد محلول اتانولی در اصل شامل قندها و اسیدهای آمینه بودند، مواد محلول بعدی در اصل شامل نشاسته بود. توزیع کربن 14C درمیان مواد واسطه و محصولات نهایی فتوسنتزی با روش Calvin-Bassham بنا به شرح مقاله (17) تعیین گردید. قندها در عصاره های ترکیبی اتانول و آب انالیز گردیدند. گلوکز با استفاده از گلوکزاکسیداز و او-دیانیزیدین دهیدروکلراید برآورد گردید.
فسفاتهای قندی روی 3 گرم از ماده برگ تازه نمونه برداری شده در وسط روز و بلافاصله هموژنیزه شدن در 12 میلی لیتر محیط سرد شده با یخ و حاوی 50mM MeS-NaOH تحت pH 6.0 و 0.5 g PVPP ، 150 mg BSA و 10mM DTT تعیین گردیدند. بعد از سانتریفوژ با سرعت 15000g لایه رویی به کمک HClO4 (با غلظت نهایی 15%) دپروتئینه گردید و به کمک KOH خنثی گردید. سپس این عصاره به مدت 2 دقیقه با کربن فعال شده در دستگاه همزن شیکر قرار گرفت.
ما این روش را روی مواد خود با روش مقاله Seeman & Sharkey (225) و نیز مقاله Lilley و همکارانش (15) مقایسه کردیم. برگ در نیتروژن N2 مایع منجمد گردید ضمن اینکه همچنان به گیاه متصل بود، سپس در نیتروژن N2 مایع خرد شده و به کمک HClO4 عصاره گیری گردید ضمن اینکه همچنان در حالت یخ زده قرار داشت. بعد از تجزیه بعدی، فسفاتهای قندی براساس مساحت برگ بیان گردیدند. در یک مجموعه از آزمایشات مقادیر بدست آمده برای این دو روش خیلی نزدیک بهم بود، و مقادیری که با دومین روش بدست آمد همچنان بطور خیلی جزئی پایین تر بود
بعد از سانتریفوژ، لایه رویی برای تعیین دو فسفات هگزوز استفاده گردید. متعاقبا سنجش به کمک گلوکز 6-P دهیدروژناز و P-گلوکز ایزومراز انجام شد.
سوکروز به شکل قند احیاکننده بعد از هیدرولیز KOH طبق مقاله Handel (8) تخمین زد. ما این روش را برای ماده خود براساس روش گلوکز اکسیداز استاندارد کالیبره کردیم و یک رابطه خطی را بین مقادیر بدست آمده با این دو تکنیک بدست آوردیم. معادله ای که بیان کننده این نسبت بود برابر با y=0.036+1.6x می باشد (ضریب همبستگی رگرسیون 0.86 می باشد)، که در آن y غلظت سوکروز بنا به اندازه گیری با روش دیگری است و X غلظتی است که به کمک گلوکزاکسیداز اندازه گیری می شود. نشاسته با روش مقاله 17 تجزیه گردید.
ABSTRAC
When seven crop species were grown under identical environmental conditions, decreased sink:source ratio led to a decreased photosynthetic rate within 1 to 3 days in Cucumis sativus L., Gossypium hirsutum L., and Rapwaaus sativus L, but not in Capsicum annuum L., Solanum melongena L., Phaseolus vulgaris L., or Ricinus communis L. The decrease was not associated with stomatal closure. In cotton and cucumber, sink removal led to an increase in starch and sugar content, in glucose 6-phosphate and fructose 6-phosphate pools, and in the proportion of '4C detected in sugar phosphates and UDPglucose following '4CO2 supply. When mannose was supplied to leaf discs to sequester cytoplasmic inoranic phosphate, promotion of starch synthesis, and inhibition of C02 fixation, were observed in control discs, but not in discs from treated plants. Phosphate buffer reduced starch synthesis in the latter, but not the former discs. The findigs suggest that sink removal led to a decreased ratio inorganic phosphate:phosphorylated compounds. In beans '4C in sugar phosphates increased following sink removal, but without sucrose accumulation, suggesting tighter feedback control of sugar level. Starch accumulated to higher levels than in the other plants, but CO2 frxation rate was constant for several days.
Altered sink demand has been observed to lead to a change in the photosynthetic rate of the source leaf in a number of species (6). The mechanism by means of which the requirements of the sink are transmitted to the source is still far from clear (10). Moreover, in some investigations no such sink/source interaction has been detectable. Some of the contrasting results in the literature may have resulted from differences between growing conditions and experimental procedure in different laboratories; others, to differences in response between different species. We have been conducting an investigation into the effect of procedures which alter translocation rates on the metabolic activities of source leaves in several plant species grown under the same controlled environmental conditions. We recently reported (17) on two effects observable in cucumber following steam-girdling or sink removal. A short-term effect was maximal after 3 h with subsequent recovery, and involved stomatal closure probably induced by temporary increases in leaf water stress and ABA level, with no detectable change in the pattern of 14C incorporation into metabolites. A long-term effect was detected after 3 and involved changes in the relative amount of 14C incorporated into various photosynthetic products and intermediary compounds, but was not associated with stomatal responses. Herein we report on the long-term effects of sink metabolism in a number of other species and discuss the findings in relation to the possible nature of the signal transmitting sink demand to source activity.
MATERIALS AND METHODS
Cotton (Gossypium hirsutum L. cv Acala Sj-2), bean (Phaseolus vulgaris L. cv Bulgarian), cucumber (Cucumis sativus L. cv Dalila), radish (Raphanus sativus L. cv Munchner Bierrettich), bell pepper (Capsicum annuum L. cv California Wonder), eggplant (Solanum melongena L. cv Black Beauty), and castor bean (Ricinus communis L.) were grown in 2-L cylindrical plastic containers filled with vermiculite. Plants were thinned to one plant per pot shortly after emergence and irrigated twice a week with deionized water and once a week with half-strength Hoagland solution. Excess water and solution were drained through the bottom of the container. All species were grown in a chamber maintained at 25C, at a quantum flux density of 450 ,umol m-2 s-' (400-700 nm) and a 13 h/ll h light/dark photoperiod.
Experiments with cotton were conducted about 10 d after the appearance of the first flower (11-12 weeks after emergence). Bean plants were used at the stage of the fully expanded first trifoliate leaf (22-25 d after emergence).
One experiment with cotton (Fig. 1) was conducted on field grown plants, Cotton was planted on May 25 in rows 1 m apart and thinned to 10 plants/m2 after emergence. Following light sprinkling to ensure emergence, a trickle irrigation system was installed. Laterals were located next to plant rows and emitters were 40 cm apart. The plants were irrigated once a day and the quantity of water supplied was based on evaporation from a Class A pan. Nutrients containing urea, H3PO4 and KCI at N:P:K ratio of 4:1:2 were predissolved in the irrigation water at a concentration of 80 g x m-3. Plants were used for this experiment on August 12, when there were about 10 bolls or flowers per plant.
The sink removed in the case of the growth-chamber grown cotton was the developing first boll, and measurements were conducted on the mature leaf adjacent to this boll peduncle. In the field-grown cotton, various numbers of boils or flowers were removed, and measurements were conducted on four leaves of different ages along the plant axis. The extracts of these were combined. In the case ofbean plants, the sink removed included the young developing second trifoliate leaf and developing buds. The first trifoliate leaf was considered as the source leaf.
CO2 fixation rate was measured in 1.5 cm2 circular areas of attached leaves according to a procedure described earlier (12).
These areas were enclosed in a microchamber and flushed with an air stream containing 300 Al L-' 4C02 + 12C02 for 60 s. Ethanol soluble substances and HClO4-soluble substances were determined as in Mayoral et al. (17). The former comprised mainly sugars and amino acids, the latter mainly starch. Distribution of 14C among intermediates and end products of photosynthesis were determined by the calvin-Bassham method as described earlier (17). Sugars were analyzed in the combined ethanol and H20 extracts. Glucose was estimated using glucose oxidase and 0-dianizidine dehydrochloride.
Sugar phosphates were determined on 3 g fresh leaf material sampled at midday and immediately homogenized in 12 ml icecold medium containing 50 mm MeS-NaOH (pH 6.0), 0.5 g PVPP, 150 mg BSA, and 10 mM DTT. Following centrifugation at 1 5,000g the supernatant was deproteinized with HC104 (final concentration 15%) and neutralized with KOH. The extract was then shaken for 2 min with activated carbon.
We have compared this method on our material with that of Seeman and Sharkey (25) and Lilley et al. (15). The leaf was frozen in liquid N2 while still attached to the plant, then ground in liquid N2 and extracted with HC104 while still in the frozen state. After subsequent analysis, the sugar phosphates were expressed on the basis of leaf area. In a series of tests the values obtained for the two methods were very close, those obtained by the second method being consistently very slightly lower.
After centrifugation the supematant was used for determination of the two hexose phosphates. The assay was conducted sequentially with glucose 6-P dehydrogenase and P-glucose isomerase (13).
Sucrose was estimated as reducing sugar following KOH hydrolysis according to Handel (8). We have calibrated this method for our material against the standard glucose oxidase method, and have found a linear relationship between the values obtained by the two techniques. The equation expressing this proportionality is y = 0.036 + 1.6x (regression coefficient 0.86), where y is the sucrose concentration as assayed by the anthrone method (8) and x is that assayed by glucose oxidase. Starch was analyzed as outlined earlier (17).
چکیده
مواد و روشها
نتایج
بحث
منابع
ABSTRACT
MATERIALS AND METHODS
RESULTS
DISCUSSION
LITERATURE CITED
