
دانلود رایگان مقاله تأثیر استفاده از تغذیه تخمه آفتابگردان سالم غیرفرآورده و تخم کتان بر تولید شیر
چکیده
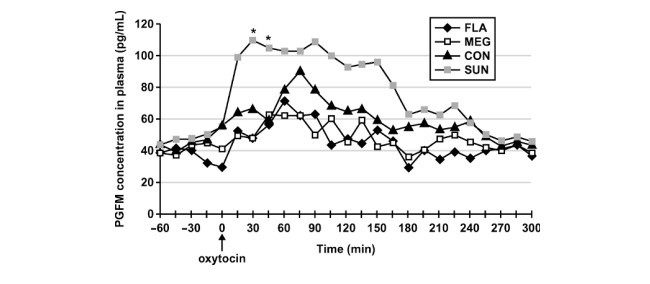
چهار گاو هلشتاین چند زا را در یک آزمایش طرح مربع لاتین 4×4 مورد استفاده قرار دادیم تا تأثیرات منابع مختلف چربی بر روی تولید و ترکیب شیر، N بهره برداری، توسعه فولیکولی، و تراوش پروستا گلاندین را مطالعه کنیم. چهار جیره غذایی ترکیلی کلی (TMR) را بر اساس نمک های کلسیم روغن پالم (مگالاک )، تخم بزرک سالم، تخمه آفتابگردان سالم، یا عدم چربی مکمل (گروه کنترل) به عنوان تغذیه به گاوها می دادیم. ورودی تغذیه و قابلیت هضم آنها عموماً در بین آزمایشات مشابه بودند، بجز اینکه قابلیت هضم عصاره اتر برای گاوهایی که از رژیم غذایی کنترل استفاده میکردند، پایین تر بود. بازده شیر برای گاوهایی که تخم بزرک و مگالاک سالم مصرف میکردند (بترتیب 32.1 و31.5 کیلوگرم/روز) در مقایسه با گاوهایی که تخمه آفتابگردان و رژیم غذایی کنترل مصرف میکردند (بترتیب 25.9 و 24.8 kg/d)، بیشتر بود. غلظت پروتئین شیر برای گاوهایی که مگالاک (3.68 درصد) مصرف میکردند در مقایسه با گاوهایی که تخم بزرک (3.87 درصد) یا رژیم غذایی کنترل (3.92 درصد) مصرف می کردند خیلی کمتر بود. غلظت های اسیدهای چرب n-3 و نسبت اسیدهای چرب n-6 به n-3 در شیر برای گاوهایی که تخم بزرک سالم مصرف میکردند بترتیب بالاترین و پایین ترین مقدار بودند. اثرات متقابلی بین آزمایش و زمان برای سطوح 13,14 dihydro 15 keto PGF2α در پلاسما وجود داشت؛ آنها 30 و 45 دقیقه بعد از چالش اکسی توسین برای گاوهایی که تخمه آفتابگردان مصرف میکردند در مقایسه با گاوهایی که ماگالاک، تخم بزرک یا رژیم غذایی کنترل مصرف میکردند، بزرگتر بودند. به علاوه زمانی که غلظت های 13,14 dihydro 15 keto PGF2α در پلاسما به صورت منطقه زیر منحنی پاسخ کلی از 0 تا 120 دقیقه بعد از تزریق اکسی توسین بیان میشد، برای گاوهایی با رژیم غذایی تخمه آفتابگردان در مقایسه با گاوهایی با رژیم غذایی ماگالاک یا تخم بزرک، بزرگتر بود. به طور کلی پویایی فولیکول در بین آزمایشات مشابه بود. این نتایج نشان میدهد که رژیم های غذایی با نسبت های بالایی از اسیدهای چرب n-6 (61 درصد از کل اسیدهای چرب برای رژیم غذایی تخمه آفتابگردان) سبب افزایش تراوش سری 2 از پروستا گلاندین در خون می گردند.
مقدمه
اسیدهای چرب با چند پیوند غیراشباع (FA) در رژیم غذایی سالم تر از FA اشباع شده شناخته میشوند. در نتیجه دستکاری خصوصیات FA چربی های شیر برای پاسخ دادن به تقاضاهای مصرف کنندگان مورد توجه زیادی قرار گرفته است. مصرف دانه های روغنی برای شیر دادن گاوهای شیری، روشی برای تغییر نسبت FA اشباع نشده در چربی شیر است و افزایش های آنها تا 40 درصد خواهد بود (کاسپر و همکارانش 1990؛ استیگمان و همکارانش 1992؛ کیم و همکارانش 1993)، اگرچه معمولاً هیدروژنه کردن زیستی زیادی در شکمبه رخ میدهد (پالم کویست و جنکینز 1980). تخمه آفتابگردان و تخم بزرک از دیدگاه مصرف کننده یک انتخاب خوب هستند چون هر دوی آنها غنی از FA با چند پیوند غیراشباع هستند و تخمه آفتابگردان منبعی از اسید لینولئیک (66 درصد اسیدهای چرب کلی) است که یک n-6 FA است در حالی که تخم بزرک غنی از اسید لینولئیک (56 درصد اسیدهای چرب کلی) است که یک n-3 FA است. در حقیقت هم تخم بزرک سالم و هم تخمه آفتابگردان سالم منابع چربی قابل قبولی برای گاوهای شیرده میانی هستند چون زمانی که با نرخ 13 تا 15 درصد از DM تغذیه میکنند همان مقدار شیر را تولید میکنند (پتیت 2003)، اما هیچ اطلاعاتی در مورد تأثیرات تغذیه از تخمه آفتابگردان بر روی بازده شیر گاوهای شیرده اولیه وجود ندارد. به علاوه تکمیل روغن تخمه آفتابگردان (6 درصد DM) سبب کاهش چشمگیر تعداد پروتوزوا در مایع شکمبه در مدت 5 روز میشود (ایوان و همکارانش 2001) و این نشان میدهد که دانه های روغنی عناصر سازنده غذایی بالقوه ای برای کنترل جمعیت پروتوزوا در جانوران نشخوارکننده هستند و سبب افزایش کارایی استفاده از پروتئین غذایی میگردد.
اسید لینولئیک (C18:2n-6) به پروستا گلاندین های (PG) اسید آرچیدونیک (سری 2) همچون PGF2α تبدیل میشود. همان آنزیم های الانگاز و دساچیوراز، رژیم غذایی اصلی n-3 FA (اسید لینولنیک-α؛ C18:3n-3) را به اسید ایکوزاپنتا انوئیک (C20:5n-3)، پیش ماده PG ترینوییک (سری 3) – همچون PGF3α – نیز تبدیل میکنند (آبایا سکارا و واتز 1999). رقابت بین پیش ماده های n-3 و n-6 برای اشباع زدایی و طویل کردن، و همچنین در سایت سنتتاز PG به این معنا است که افزایش عرضه n-3 FA سبب کاهش تولید PG دینوییک میشود (بارنوئین و چاسان 1991). در بسیاری از موارد PG ترینوییک فعالیت زیست شناختی کمتری در مقایسه با PG دینوییک متناظر دارد (فلای و جانستون 1990) و این میتواند تأثیر مستقیمی روی جنبه های باروری داشته باشد. به عنوان مثال آزمایشاتی که سنتز تخمدان و آندومتر PGF2α را کاهش میدهند به هزینه PGF3α میتوانند به کاهش مرگ و میر رویانی کمک کنند (ماتوس و همکارانش 2000). پس مصرف یک رژیم غذایی غنی از اسید لینولئیک در مقایسه با یک رژیم غذایی غنی از اسید لینولنیک – که میتواند تأثیرات منفی روی تولید مثل گله داشته باشد – میتواند به افزایش تراوش PGF2α کمک کند. با این حال هیچ اطلاعاتی در مورد تأثیرات مصرف تخمه آفتابگردان سالم (که غنی از n-6 FA است) بر روی تراوش پروستا گلاندین وجود ندارد. بنابراین اهداف آزمایش حاضر این بود که تأثیرات منابع مختلف چربی بر روی تراوش پروستا گلاندین و N بهره برداری رژیم غذایی را مورد مطالعه قرار دهد.
مواد و روشها
حیوانات و رژیم های غذایی
چهار گاو هلشتاین شیری چند زا با میانگین 38 DIM (SEM = 7) و 654 کیلوگرم BW (SEM = 55 kg) در یک طرح مربع لاتین 4×4 در چهار دوره 35 روزه مورد استفاده قرار گرفت. گاوها در اتاقک های فردی در اصطبل نگهداری میشدند و دسترسی آزادی به آب داشتند. گاوها دو بار در روز در ساعت های 07:30 و 16:00 دوشیده میشدند. تمام گاوها دو بار در روز (ساعت های 08:00 و 16:00) 4 TMR رژیم غذایی مورد علاقه خود (با میزان امتناع 10 درصدی) را بر مبنای ترکیبی از علف و برگ ذرت (جدول 1) انتخاب می کردند که شامل یکی از موارد روبرو بود: نمکهای کلسیم روغن پالم (روغن نخل)، مگالاک (MEG)؛ 2) تخم بزرک سالم غیرفرآورده (FLA)؛ 3) تخمه آفتابگردان غیرفرآورده سالم (SUN)؛ یا 4) فقدان چربی در کنسانتره (CON، جدول 4). تمام TMR ها با مکمل چربی (جدول 3) طوری طراحی شده بودند که ورودی های چربی مشابهی را به صورت درصدی از DMI کلی ایجاد کنند و 4 رژیم غذایی ایزو نیتروژنی و هم انرژی محاسبه شدند. 4 رژیم غذایی تنظیم شدند تا الزامات گاوهایی را برآورده سازند که 640 کیلوگرم BW داشتند و 35 kg/d شیر با 3.8 درصد چربی تولید میکردند (NRC, 1989). مطابق با دستورالعمل های انجمن مراقبت از حیوانات کانادا (1993) از حیوانات نگهداری میشد.
روشهای آزمایش
انطباق با رژیم های غذایی از روز 1 تا روز 14، نمونه گیری شیر و جمع آوری کلی مدفوع و ادرار از روز 14 تا روز 20، و اولترا سونوگرافی ترانس رکتال از روز 20 تا روز 35 بود. روشهایی برای همزمان سازی فحلی، اسکن با امواج فراصوت و چالش اکسی توسین دقیقاً عین روشهایی بودند که قبلاً توسط آلدیک و همکارانش (1997) با استفاده از یک طرح مربع لاتین 4×4 با چهار دوره 35 روزه توصیف شده بود. مصرف غذا و بازده شیر به صورت روزانه اندازه گیری میشدند. بازده 4% FCM مطابق با معادله تیرل و رِید (1965) محاسبه شد. اجزای تشکیل دهنده مواد غذایی و TMR هر هفته 3 بار (موقع روز و در طی ارزیابی قابلیت هضم) نمونه برداری می شدند و به صورت هفتگی با هم ادغام می شدند. تمام نمونه ها برای تحلیل های شیمیایی متعاقب در دمای –20℃ منجمد شدند. نمونه های شیر از هر ردیف برای 14 دوشیدن متوالی بدست آمدند، بر اساس بازده با هم ادغام شدند، و برای N، لاکتوز، چربی و اسیدهای چرب تحلیل شدند. شیر 3 بار در هفته جمع آوری میشد و نمونه ها به صورت منجمد نگهداری میشدند تا غلظت متعاقب پروستا گلاندین تعیین، و آغاز یک چرخه فحلی جدید تأیید شود. مدفوع از یک تشک لاستیکی جمع آوری شد که پشت سر حیوانات قرار داده شده بود؛ این مدفوع در ظرف های پلاستیکی نگهداری شد. مقدار مدفوع روزانه به طور کامل وزن و ترکیب شد. یک زیرنمونه 10 درصدی در دمای –15℃ برای خشک کردن متعاقب در دمای 55℃ گرفته و نگهداری شد. ادرار کلی روزانه در ظرف هایی از جنس فولاد ضد زنگ و از طریق لوله Gooch جمع آوری شد (شرکت BF Goodrich، کیچنر، ON، کانادا) که با یک تور نایلونی پوشیده شده با نئوپرین به فرج گاو متصل شده بودند (شرکت Spall Bowan، گولف، ON، کانادا). یک زیرنمونه 1 درصدی به صورت روزانه گرفته میشد و تا زمان تحلیل به صورت منجمد نگهداری میشد. ادرار به صورت روزانه با 100 mL از 10 N H2SO4 اسیدی میشد.
چرخه های فحلی در هر دوره همگام می شدند. در روز 14 ام، یک GnRH agonist (سیستورلین؛ رون میروکس، ویکتوریا ویل، QC، کانادا) با یک تزریق i.m. (8 μg) برای هر گاو انجام میشد، و سپس 7 روز بعد توسط یک تزریق i.m. از PGF2α تکمیل میشد (25 mg، لوتالیز، شرکت Pharmacia and Upjohn، اورانگویل، ON، کانادا). این برنامه هم توسعه فولیکولی و هم بازگشت جسم زرد (CL) را همگام می سازد (تاچر و همکارانش 1989؛ مک میلاند و تاچر 1991). بازگشت CL با استفاده از اولترا سونوگرافی تأیید شد. تخمدان های هر گاو از طریق اولترا سونوگرافی و با استفاده از یک اسکنر امواج فراصوت LS-300A آزمایش شد که به یک آرایه خطی از پروب 5 MHz مجهز بود (شرکت Tokyo Keiki، توکیو، ژاپن)؛ این آزمایش در اواسط صبح هر روز از روز 20 ام تا روز 35 ام در هر دوره آزمایش انجام شد. اندازه و تعداد فولیکول های تخمدان بزرگتر از 3 میلیمتر ثبت شدند. فولیکول ها در سه کلاس با قطرهای مختلف برای انجام تحلیل، گروه بندی شدند: کلاس 1 (3.0 تا 4.9 میلیمتر)، کلاس 2 (5.0 تا 9.9 میلیمتر)، و کلاس 3 (بزرگتر یا مساوی با 10 میلیمتر). اندازه CL نیز ثبت شد. در روز 34 ام یک سوند داخل سیاهرگ گردن قرار داده شد. در روز بعد یک چالش اکسی توسین روی گاوها انجام شد تا تولید زهدانی PGF2α تحریک شود – همانطور که توسط آلدیک و همکارانش (1997) نیز توصیف شده است. بترتیب در ساعات 06:00 و 10:00 استرادیول (3 mg) و اکسی توسین (20 IU؛ شرکت Pfizer Canada) به صورت درون وریدی و از طریق سوند زیرگلویی انجام شد. خون در لوله های حاوی هپارین لیتیوم (بکتون دیکینسون و سای، راترفورد، JN) در فواصل زمانی 15 دقیقه ای به مدت 1 ساعت قبل از تزریق اکسی توسین و در فواصل زمانی 15 دقیقه ای به مدت 5 ساعت بعد از تزریق اکسی توسین جمع آوری شد. پلاسما در دمای –20℃ برای تحلیل متعاقب PGFM، متابولیت اصلی PGF2α و پروژسترون، جداسازی و منجمد میشود. در ساعت 09:00 همچنین خون در لوله های Vacutainer قرار داده می شود (بکتون دیکینسون و سای) که حاوی هپارین لیتیوم برای تعیین گلوکز، EDTA برای اسیدهای چرب و تحلیل NEFA، یا فقدان مواد نگهدارنده برای تحلیل کلسترول هستند.
تحلیل شیمیایی
ماده خشک اجزای تشکیل دهنده مواد غذایی و TMR توسط خشک شدن در دمای 100℃ به مدت 48 ساعت تعیین شدند. نمونه های مواد غذایی و مدفوع از طریق یک نمایشگر 1 میلیمتری در یک آسیاب Wiley گرفته شد (مدل 3؛ آرتور ام. توماس، فیلادلفیا، PA). تعیین N کلی توسط روش Kjeldahl انجام شد (AOAC, 1990). هم ADF و هم NDF مطابق با روشهای غیرمتوالی وان سوئیست و همکارانش (1991) و بدون استفاده از آمیلاز و سولفات سدیم اندازه گیری شدند. انرژی ناخالص با احتراق در یک گرماسنج بمب Parr اندازه گیری شد (مدل 1241، شرکت Parr Instrument، مالین، IL). عصاره اتر در اجزای تشکیل دهنده مواد غذایی، رژیم های غذایی، و نمونه های مدفوع با یک دستگاه HT6 سیستم Soxlec (تکاتور، Fisher Scientific، مونترال، QC، کانادا) و مطابق با روش شماره 7.060 انجام شد (AOAC, 1990). غلظت لیپید در مگالاک توسط احتراق مواد آلی در دمای 550℃ در مدت یک شبانه روز در یک کوره موفلی تعیین شد (AOAC, 1990). پلاسما NEFA با استفاده از یک کیت رنگ سنجی تعیین شد (کیت شماره 9075401؛ صنایع مواد شیمیایی Wako Pure، اوزاکا، ژاپن)، و سپس اصلاحاتی توسط جانسون و پیترز (1993) انجام شد. کلسترول کلی و HDL در پلاسما (بترتیب کیت های شماره 401 و 352؛ شرکت Sigma Chemical، سنت لوئیس، MO) طبق توضیحات سیدل و همکارانش (1983) تعیین شد. گلوکز در پلاسما با استفاده از یک کیت رنگ سنجی (کیت شماره 14448668؛ روشه/هیتاچی، ایندیاناپلیس، IN) مطابق با روش تریندر (1969) تعیین شد.
غلظت کلسترول LDL به صورت تفاوت بین غلظت های کلسترول کلی و HDL محاسبه شد. نمونه های پلاسما در نسخه المثنی برای PGFM برای ایمنی سنجی پرتویی مطابق با پژوهش گیلبالت و همکارانش (1984) آزمایش شدند. پادتن PGFM هدیه ای از ویلیام تاچر (دانشگاه فلوریدا) بود و استانداردهای PGFM و رقیب ([5,6,8,9,11,12,14(n) 3H]13,14 Dihydro 15 keto PGF2α; 186 Ci/mmol) از شهر امرشام خریداری شدند (پیسکاتاوی، NJ). پلاسما بدون مقادیر قابل شناسایی از PGFM برای استفاده در استانداردها از یک گاو جمع آوری شد که دو بار (با فاصله زمانی 12 ساعته) آزمایش شده بود؛ این کار با یک تزریق درون وریدی یک بازدارنده سنتز پروستا گلاندین انجام شد: 10 mL از 50 mg/mL (500 mg) مگلومین فلونیکسین (بانامین، شرکت بهداشت حیوانات Schering-Plough، کنیل ورت، NJ). خون را در قمقمه های هپارین زده تخلیه شده 4 ساعت بعد از تزریق دوم جمع آوری کردیم، سپس آنرا روی یخ قرار دادیم و به مدت 20 دقیقه در دمای 4℃ در 5000×g تحت نیروی مرکز گریز قرار دادیم. پلاسما را جدا ساختیم و آنرا در دمای –20℃ نگهداری نمودیم. موازی سازی یک استخر از گاوها برای تمام آزمایشات اثبات شد و میانگین بهبودی – که با اضافه سازی دوزهای مختلفی از هورمون های بدون برچسب در یک نمونه ادغامی محاسبه میشد – برای تمام آزمایشات بین 99 تا 113 درصد متغیر بود. حساسیت این آزمایش برای 200 μL از پلاسما 31.25 pg/mL بود و ضرایب درون آزمایشات و میان آزمایشات بترتیب 7.5 و 12.1 درصد بود.
نمونه های شیر جمع آوری شده در طی آزمایش هضم را برای پروتئین خام (N×3.68) و چربی بترتیب با استفاده از روشهای جلداهل و روئیس-گاتلیب تحلیل کردیم (AOAC, 1990). غلظت لاکتوز در شیر توسط یک روش رنگ سنجی (کیت 176 303؛ Boehringer Mannheim، سنت ویلی، لورنت، QC، کانادا) و مطابق با AOAC (1984, 1990) تعیین شد. غلظت های شیر پروژسترون توسط ایمنی سنجی پرتویی (بالمن و لامینگ 1978) در نمونه های المثنی اندازه گیری شد و ضرایب تغییر درون آزمایشی و میان آزمایشی بترتیب 13 و 13 درصد بودند. اسیدهای چرب در پلاسما و شیر استخراج شدند، متیل دار شدند، و مطابق با روشهایی که قبلاً توسط پتیت (2002) استفاده شده بود آماده شدند. خصوصیات متیل استر اسید چرب توسط GLC در یک سوانگار Hewlett Packard 6890 (شرکت Hewlett Packard، مونترال، QC، کانادا) با یک G1315A autosampler مجهز به یک آشکارساز یونش شعله ای و یک تزریق کننده شکافدار-بدون¬شکاف ارزیابی شد – همانطور که توسط دلبچی و همکارانش (2001) توصیف شده است.
ABSTRACT
Four multiparous Holstein cows were used in a 4 × 4 Latin-square design experiment to study the effects of different fat sources on milk production and composition, N utilization, follicular development, and prostaglandin secretion. Cows were fed 4 total mixed rations (TMR) based either on calcium salts of palm oil (Megalac), whole flaxseed, whole sunflower seed, or no supplementary fat (control). Feed intake and digestibilities were generally similar among treatments, except that ether extract digestibility was the lowest for cows fed the control diet. Milk yields were greater for cows fed whole flaxseed and Megalac (32.1 and 31.5 kg/d, respectively) than for those fed sunflower seed and control (25.9 and 24.8 kg/d, respectively). Milk protein concentration was significantly lower for cows fed Megalac (3.68%) compared with those fed flaxseed (3.87%) or control (3.92%). Concentrations of n-3 fatty acids and the n-6 to n-3 fatty acids ratio in milk were the highest and lowest, respectively, for cows fed whole flaxseed. There was an interaction between treatment and time for levels of 13,14-dihydro-15-keto-PGF2α in plasma; they were greater 30 and 45 min after the oxytocin challenge for cows that were fed sunflower seed compared with those fed either Megalac, flaxseed, or control. Moreover, when concentrations of 13,14-dihydro15-keto-PGF2α in plasma were expressed as the area under the overall response curve from 0 to 120 min after the oxytocin injection, it tended to be greater for cows that were fed the sunflower diet compared with those fed either Megalac or flaxseed. In general, follicle dynamics were similar among treatments. These results suggest that feeding diets with high proportions of n-6 fatty acids (61% of total fatty acids for the sunflower seed diet) tended to increase the secretion of series 2 prostaglandins in blood.
INTRODUCTION
Dietary polyunsaturated fatty acids (FA) are perceived to be healthier than saturated FA. As a result, there has been a great deal of interest in manipulating the FA profile of milk fat to respond to consumers’ demands. Feeding oilseeds to lactating dairy cows is one method to change the proportion of unsaturated FA in milk fat, with increases as high as 40% (Casper et al., 1990; Stegeman et al., 1992; Kim et al., 1993), although extensive biohydrogenation occurs normally in the rumen (Palmquist and Jenkins, 1980). Sunflower seed and flaxseed would be a good choice from a consumer point of view, as both are rich in polyunsaturated FA, with sunflowers being a source of linoleic acid (66% of total fatty acids), which is an n-6 FA, whereas flaxseed is rich in linolenic acid (56% of the total fatty acids), which is an n-3 FA. In fact, both whole flaxseed and whole sunflower seed are acceptable fat sources for midlactating cows, as they result in similar milk yields when fed at a rate of 13 to 15% of the DM (Petit, 2003), but there is no information on the effects of feeding whole sunflower seed on milk yield of early lactating cows. Moreover, sunflower seed oil supplementation (6% of DM) dramatically reduces protozoa numbers in rumen fluid within 5 d (Ivan et al., 2001), suggesting that oilseeds are potential feed ingredients to control protozoa populations in ruminants and to increase the efficiency of dietary protein utilization.
Linoleic acid (C18:2n-6) is converted to arachidonic acid (C20:4n-6), which is the precursor of the dienoic (2- series) prostaglandins (PG), such as PGF2α. The same elongase and desaturase enzymes also convert the main dietary n-3 FA (α-linolenic acid; C18:3n-3) to eicosapentaenoic acid (C20:5n-3), the precursor of the trienoic (3- series) PG, such as PGF3α (Abayasekara and Wathes, 1999). Competition between n-3 and n-6 precursors for desaturation and elongation, as well as at the site of PG synthetase, means that increasing the supply of n3 FA will decrease production of dienoic PG (Barnouin and Chassagne, 1991). In many cases, the trienoic PG have lower biological activity than the corresponding dienoic PG (Fly and Johnston, 1990), and this may directly affect aspects of fertility. For example, treatments that reduce ovarian and endometrial synthesis of PGF2α, at the expense of PGF3α, may contribute to a reduction in embryonic mortality (Mattos et al., 2000). Feeding a diet rich in linoleic acid could then contribute in increasing secretion of PGF2α, compared with feeding a diet rich in linolenic acid, which could have negative effects on reproduction of cattle. There is, however, no information on the effects of feeding whole sunflower seed, which are rich in n-6 FA, on prostaglandin secretion. Therefore, the objectives of the present experiment were to study the effects of feeding different fat sources on prostaglandin secretion and dietary N utilization.
MATERIALS AND METHODS
Animals and Diets
Four multiparous lactating Holstein cows, averaging 38 DIM (SEM = 7) and 654 kg of BW (SEM = 55 kg), were used in a 4 × 4 Latin-square design over four 35- d periods. The cows were kept in individual stalls and had free access to water. Cows were milked twice a day at 0730 and 1600 h. All cows were fed ad libitum (10% refusals) twice a day (0800 and 1600 h) 4 TMR based on a mixture of grass and corn silages (Table 1) and containing either 1) calcium salts of palm oil, Megalac (MEG), 2) whole unprocessed flaxseed (FLA), 3) whole, unprocessed sunflower seed (SUN), or 4) no fat in the concentrate (CON, Table 2). All fat-supplemented TMR (Table 3) were designed to yield similar fat intakes as a percentage of total DMI, and the 4 diets were calculated to be isonitrogenous and isoenergetic. The 4 diets were formulated to meet requirements for cows that were 640 kg of BW, producing 35 kg/d of milk with 3.8% fat (NRC, 1989). Animals were cared for according to the guidelines of the Canadian Council on Animal Care (1993).
Experimental Procedures
Adaptation to diets was from d 1 to 14, milk sampling and total fecal and urine collection from d 14 to 20, and transrectal ultrasonography from d 20 to 35. Procedures for estrus synchronization, ultrasound scanning, and oxytocin challenge were the same as those previously described by Oldick et al. (1997) using a 4 × 4 Latin-square design with four 35-d periods. Feed intake and milk yield were measured daily. Yield of 4% FCM was calculated according to the equation of Tyrrell and Reid (1965). Feed ingredients and TMR were sampled 3 times each week (daily during the measurement of digestibility) and pooled weekly. All samples were frozen at −20°C for subsequent chemical analyses. Milk samples were obtained from each cow for 14 consecutive milkings, pooled on a yield basis, and analyzed for N, lactose, fat, and fatty acids. Milk was collected 3 times a week, and samples were kept frozen to determine later progesterone concentration and confirm the beginning of a new estrus cycle. Feces were collected from a rubber mat placed behind the animals and stored in plastic containers. Daily feces were weighed and mixed thoroughly. A 10% subsample was taken and stored at −15°C for subsequent drying at 55°C. Total daily urine was collected in stainless steel containers via Gooch tube (BF Goodrich Co., Kitchener, ON, Canada) attached to the cow with a nylon netting covered with neoprene (Spall Bowan Ltd., Guelph, ON, Canada) affixed to the vulva. A 1% subsample was taken daily and kept frozen until analysis. Urine was acidified daily with 100 mL of 10 N H2SO4.
Estrus cycles were synchronized in each period. On d 14, a GnRH agonist (Cystorelin; Rhoˆne Me´rieux, Victoriaville, QC, Canada) was administered (8 μg) i.m. to each cow, followed 7 d later by an i.m. injection of PGF2α (25 mg; Lutalyse; Pharmacia and Upjohn Ltd., Orangeville, ON, Canada). This program synchronizes both follicular development and regression of the corpus luteum (CL) (Thatcher et al., 1989; Macmilland and Thatcher, 1991). Regression of the CL was confirmed using ultrasonography. Ovaries of each cow were examined by ultrasonography using an LS-300A ultrasound scanner equipped with a linear array 5 MHz probe (Tokyo Keiki Co. Ltd., Tokyo, Japan) in midmorning on each day from d 20 to 35 of each experimental period. Size and number of ovarian follicles >3 mm were recorded. Follicles were grouped into 3 diameter classes for analyses: class 1 (3.0 to 4.9 mm), class 2 (5.0 to 9.9 mm), and class 3 (≥10 mm). Size of CL also was recorded. On d 34, a catheter was inserted into the jugular vein. On the following day, cows were administered an oxytocin challenge to stimulate uterine production of PGF2α as previously described by Oldick et al. (1997). At 0600 and 1000 h, respectively, estradiol (3 mg) and oxytocin (20 IU; Pfizer Canada, Inc.) were administered intravenously via the jugular catheter. Blood was collected in tubes containing lithium heparin (Becton Dickinson and Cie, Rutherford, NJ) at 15-min intervals for 1 h prior to the oxytocin injection and at 15-min intervals for 5 h after the oxytocin injection. The plasma was separated and frozen at −20°C for subsequent analysis of PGFM, the principal metabolite of PGF2α, and progesterone. Blood was also withdrawn at 0900 h into Vacutainer tubes (Becton Dickinson and Cie) containing either lithium heparin for determination of glucose, EDTA for fatty acids and NEFA analysis, or no preservative for cholesterol analysis.
Chemical Analysis
Dry matter of feed ingredients and TMR were determined by drying at 100°C for 48 h. Feed and fecal samples were ground through a 1-mm screen in a Wiley mill (model 3; Arthur M. Thomas, Philadelphia, PA). Total N determination was done by the Kjeldahl method (AOAC, 1990). Both ADF and NDF were measured according to the nonsequential procedures of Van Soest et al. (1991) without the use of amylase and sodium sulphate. Gross energy was measured by combustion in a Parr adiabatic bomb calorimeter (model 1241, Parr Instrument Co., Moline, IL). Ether extraction in feed ingredients, diets, and feces was conducted with a Soxlec system HT6 apparatus (Tecator, Fisher Scientific, Montreal, QC, Canada) according to the method No. 7.060 (AOAC, 1990). Concentration of lipid in Megalac was determined by combustion of organic matter at 550°C overnight in a muffle furnace (AOAC, 1990). Plasma NEFA was determined using a colorimetric kit (kit no. 9075401; Wako Pure Chemical Industries, Osaka, Japan), following modifications by Johnson and Peters (1993). Total and HDL cholesterol in plasma (kit no. 401 and 352, respectively; Sigma Chemical Co., St. Louis, MO) were determined as described by Seidel et al. (1983). Glucose in plasma was determined using a colorimetric kit (kit no. 14448668; Roche/Hitachi, Indianapolis, IN) according to the method of Trinder (1969).
Concentration of LDL cholesterol was calculated as the difference between total and HDL cholesterol concentrations. Plasma samples were assayed in duplicate for PGFM by radioimmunoassay according to Guilbault et al. (1984). The PGFM antibody was a gift from William Thatcher (University of Florida) and PGFM standards and competitor ([5,6,8,9,11,12,14(n)-3 H]13,14-dihydro15-keto-PGF2α; 186 Ci/mmol) were purchased from Amersham (Piscataway, NJ). Plasma without detectable amounts of PGFM for use in standards was harvested from a cow treated twice (12 h apart) with an intravenous injection of a prostaglandin synthesis inhibitor: 10 mL of 50 mg/mL (500 mg) flunixin meglumine (Banamine; Schering-Plough Animal Health Corp., Kenilworth, NJ). Blood was collected into evacuated heparinized flasks 4 h after the second injection, placed on ice, and centrifuged at 5000 × g for 20 min at 4°C. Plasma was removed and stored at −20°C. Parallelism of a pool from cows was demonstrated for all assays and average recovery, which was calculated by the addition of different doses of unlabeled hormones to a pooled sample, varied between 99 and 113% for all assays. The sensitivity of the assay was 31.25 pg/mL for 200 uL of plasma, and the intra- and interassay coefficients of variation were 7.5 and 12.1%, respectively.
Milk samples collected during the digestion trial were analyzed for crude protein (N × 6.38) and fat using the Kjeldahl and Roese-Gottlieb methods (AOAC, 1990), respectively. Concentration of lactose in milk was determined by a colorimetric method (kit 176 303; Boehringer Mannheim, Ville St. Laurent, QC, Canada), according to AOAC (1984, 1990). Milk concentrations of progesterone were measured by radioimmunoassay (Bulman and Lamming, 1978) in duplicate, and intraand interassay coefficients of variation were 13 and 13%, respectively. Fatty acids in plasma and milk were extracted, methylated, and prepared according to the methods previously used by Petit (2002). Fatty acid methyl ester profiles were measured by GLC on a Hewlett-Packard 6890 chromatograph (Hewlett-Packard Ltd., Montreal, QC, Canada) with a G1315A autosampler equipped with a flame-ionization detector and a split-splitless injector, as described by Delbecchi et al. (2001).
چکیده
مقدمه
مواد و روشها
حیوانات و رژیم های غذایی
روشهای آزمایش
تحلیل شیمیایی
تحلیل آماری
نتایج و بحث
ترکیب مواد غذایی
مصرف غذا
قابلیت هضم رژیم غذایی و تعادل N
تولید و ترکیب شیر
اسیدهای چرب شیر
تحلیل پلاسما
عملکرد تخمدان
نتیجه گیری ها
منابع
ABSTRACT
INTRODUCTION
MATERIALS AND METHODS
Animals and Diets
Experimental Procedures
Chemical Analysis
Statistical Analysis
RESULTS AND DISCUSSION
Feed Composition
Feed Intake
Diet Digestibility and N Balance
Milk Production and Composition
Milk Fatty Acids
Plasma Analysis
Ovarian Function
CONCLUSIONS
REFERENCES
