
دانلود رایگان مقاله استفاده از بنتونیت برای حذف کادمیوم از محلول های آبی
چکیده
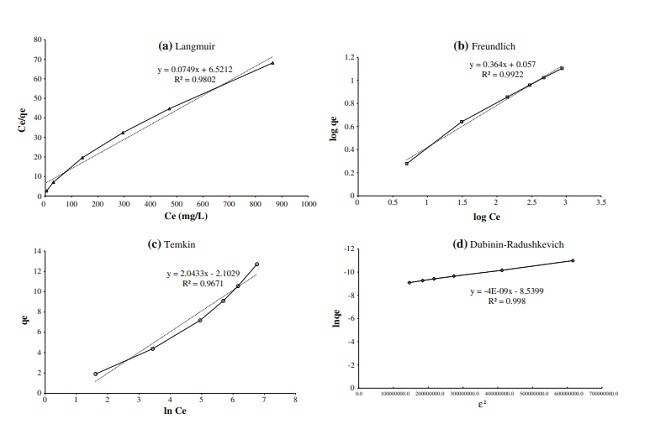
بنتونیت از منطقه بیرجند ایران توسط پراش اشعه ایکس، فلورسانس اشعه ایکس و طیف سنجی مادون قرمز تبدیل فوریه مشخص شد. حذف کادمیوم از محلول آبی توسط این بنتونیت به عنوان تابعی از شرایط مانند زمان تماس، غلظت فلز، pH محلول، سرعت هم زدن، دما، اندازه ذرات، و مقدار بنتونیت مورد بررسی قرار گرفت. خط همدمای جذب با مدل های مختلف مورد بررسی قرار گرفت: مدل های Freundlich و Dubinin-Radushkevich دارای بالاترین ضریب همبستگی، 0.9922 و 0.9988 بودند. مدل Langmuir مربوطه نشان دهنده ظرفیت جذب حداکثر 13.50 میلی گرم / گرم است. معادلات انتشار مرتبه اول، شبه مرتبه دوم، و داخل ذرات برای مطالعه مکانیسم جذب استفاده شدند؛ داده های تجربی به خوبی با سینتیک شبه مرتبه دوم مناسب بودند. پارامترهای ترمودینامیکی جذب در درجه حرارت های 293، 303، 313، و 323 K محاسبه شدند و نشان دادند که جذب کادمیم گرمازا و خود به خودی بود.
مقدمه
حضور یونهای کادمیوم در ضایعات صنعتی بر زندگی انسان و آبزیان تاثیر می گذارد (Godt و همکاران 2006؛ Lavelle 1995؛ Sharma 1995). از این رو، فرآیندهای زیادی برای حذف کادمیم مورد مطالعه قرار گرفته اند (Bedoui و همکاران 2008؛ Jianru و همکاران 2007؛ Lodeiro و همکاران 2006؛ Namasivayam و Ranganathan 1995؛ Wu و Xiong 2003)، و انواع مختلفی از بنتونیت برای حذف فلزات و دیگر آلاینده ها (Babel و Kurniawan 2003؛ Koswojo و همکاران 2010؛. . Li و همکاران 2011) استفاده شده است. توانایی جذب فلزات از قبیل کادمیم، روی، آهن، جیوه، کروم، مس، منگنز، و سرب بر روی بنتونیت به خوبی شناخته شده است (Chen و همکاران 2011؛ Inglezakis و همکاران 2007؛ Karapinar و Donat 2009؛ Vieira و همکاران. 2010؛ Wang و همکاران 2011) و بسیاری از مطالعات برشرایط مطلوب، ترمودینامیک، مدل خط همدما و سینتیک برای حذف کادمیم با استفاده از بنتونیت متمرکز شده اند (Hamidpour و همکاران 2010؛ Huang و همکاران 2011؛ Purna و همکاران 2006؛ Zhao و همکاران 2011). حداکثر حذف کادمیم بر روی بنتونیت خام و اصلاح شده در جدول 1 خلاصه شده است که بهترین جذب کادمیم متعلق به یک بنتونیت اصلاح شده با اضافه نمودن 8 hydroxyquinolinium (Bentouami و Ouali 2006). با این حال، مناسب بودن بنتونیت ایران برای جذب کادمیم مشخص نشده است. این مطالعه به منظور بررسی اثر آن و عوامل کلیدی درگیر در فرآیند جذب انجام شده است.
مواد و روش ها
بدون هیچ گونه پیش پرداخت شیمیایی، یک نمونه نماینده از بنتونیت از منطقه بیرجند در جنوب شرقی ایران مورد استفاده قرار گرفت. نمونه، خاک بود و توسط غربال استاندارد ASTM برای به دست آوردن کسرهای اندازه اسمی ذرات 600- به 425+، 425- به 300+، 300- تا 150+، و 150- میکرومتر در قطر غربال شد. پراش اشعه ایکس (XRD) و فلورسانس اشعه ایکس (XRF) برای تعیین کانی شناسی نمونه و تجزیه و تحلیل عناصر آن مورد استفاده قرار گرفت. طیف XRD و XRF با استفاده از پراش اشعه ایکس فیلیپس 1140 (α= A1. 54، 40 کیلو ولت، 30 آمپر، کالیبره با استاندارد Si) و پراش فیلیپس اشعه ایکس Xunique II به دست آمد (80 کیلو ولت، 40 آمپر، کالیبره با استاندارد Si) بود. XRD نمونه در شکل 1 نشان داده شده است، و تجزیه و تحلیل عنصری از نمونه در جدول 1. نشان داده شده است. این نتیجه نشان داد که ماده معدنی اصلی نمونه، مونتموریلونیت است. همه ترکیبات شیمیایی از شرکت Merck خریداری شدند و بدون خالص سازی بیشتر استفاده شدند.
طیف مادون قرمز از 4000 تا 400 cm¯¹ در یک ابزار Shimadzu 470 FT-IR ، با استفاده از پلت های KBr ثبت شد. طیف سنجی مادون قرمز تبدیل فوریه (FTIR) برای گروه عملکردی شیمیایی استفاده شده است. غلظت Cd (کادمیم) پس از جذب با استفاده از دستگاه طیف سنج جذب اتمی (AA) Unicom در 939 تعیین شد؛ جذب کادمیم با مقدار کادمیم در محلول محاسبه شد.
آزمایشات جذب کادمیم با استفاده از تعادل دسته ای انجام شد. همه آزمایش های جذب در یک راکتور شیشه ای 250. 0 میلی لیتر با استفاده از یک همزن مغناطیسی برای مخلوط کردن در دمای محیط انجام شد. در این مطالعه، تأثیر پارامترها، مانند جرم بنتونیت 5. 00- 60. 00 گرم / لیتر، اندازه ذرات از 150- تا 600- میکرومتر، غلظت Cd اولیه از 5.0 تا 20000 واحد در میلیون، زمان تماس 15-180 دقیقه، و تکان دهنده با سرعت 400-900 دور در دقیقه، مورد بررسی قرار گرفت و شرایط بهینه جهت به حداکثر رساندن جذب کادمیم تعیین شد. همه پارامترهای دیگر برای بررسی هر یک از پارامترها در هر آزمون ثابت نگهداشته شدند. مدل های خطوط همدمای Langmuir، Freundlich، Temkin، و Dubinin-Radushkevich (D-R) با استفاده از 5 گرم از بنتونیت اضافه شده به 100 میلی لیتر از محلول های حاوی غلظت های مختلف از کادمیم، اعم از 50 تا 2000 واحد در میلیون مورد مطالعه قرار گرفتند. همه حلال ها بلافاصله پس از هر آزمون فیلتر شدند.
برای بررسی ویژگی های جنبشی، 5 گرم از بنتونیت با 100 میلی لیتر از کادمیم در غلظت های مختلف از 100. 00، 250. 00، 500. 00، 750. 00، 1000. 00، و 1500. 0 میلی گرم / لیتر مخلوط شد. هر آزمون دسته ای در فواصل زمانی مختلف برای تعیین دوره مورد نیاز برای رسیدن به تعادل جذب و حداکثر حذف کادمیم انجام شدند. برای بررسی ترمودینامیکی، 5 گرم از بنتونیت به 100 میلی لیتر از محلول کادمیم در غلظت 100 میلی گرم / لیتر اضافه شد و مقدار حذف کادمیم در دماهای مختلف تعیین شد (293، 303، 313، و 323 K). مقدار کادمیم جذب شده بر روی بنتونیت از تفاوت بین غلظت اولیه و باقی مانده کادمیم در محلول پس از جذب انجام شد.
نتایج و بحث
مشخصه بنتونیت
مطالعه کانی شناسی نشان داد که کوارتز، اولیگوکلاز، گچ، مونتموریلونیت، و ایلیت اجزاء اصلی این نمونه بودند (شکل تکمیلی 1. فایل های تکمیلی با نسخه آنلاین این مقاله هستند). قله های پراش در °8.9392، °19.8985 و ° 26.6978 با صفحات (001)، (002)، و (003) مطابقت دارند، اگر چه صفحه (001) با اوج پراش ایلیت همپوشانی دارد. بنتونیت شامل ایلیت کمی است؛ ناخالصی اصلی در این نمونه، کوارتز بود، که در الگوی XRD با اوج پراش اصلی در 27. 7311 مشاهده (Caglar و همکاران. 2009) بود. ماده معدنی اصلی مونتموریلونیت است. حضور آهن به احتمال زیاد نشان می دهد که مقداری جذب قبلاً رخ داده است (جدول تکمیلی 1).
داده های مادون قرمز معمولا برای شناسایی ساختار حالت جامد و گروه های عملکردی خاک رس استفاده می شوند. حضور دو باند کششی در 3627. 54 و 3432. 54 cm¯¹ نشان دهنده ارتباط پیوند O-H است (شکل تکمیلی 2). باند کششی در 3627 cm¯¹ ناشی از ارتباط هیدروکسیل ساختار بنتونیت است و باند برد در 3432 cm¯¹ نشان دهنده حضور مولکول آب در ساختار، ناشی از پیوند هیدروژنی بین هیدروژن و اکسیژن از مولکول های مختلف آب است (Wang و همکاران. 2009). خمش باند ارتعاش H-O-H در مولکول آب بنتونیت در 1635 cm¯¹ مشاهده می شود. باند قوی و گسترده در 1040 cm¯¹ را می توان به Si–O از ارتعاش کششی در گروه کاربردی Si- Si -Oدر ورق های چهار ضلعی، برای ساختار مونتموریلونیت (Wang و همکاران. 2011) نسبت داد. دو باند ارتعاش خمش در 467 و 519 cm¯¹ نشاندهنده پیوندهای Si–O–Al و Si–O–Si بود. باند ارتعاش در 693 cm¯¹ و باند شانه آن (با شدت کمتر، که در متمم شکل 2 اختصاص داده نشده است) می تواند به تغییر شکل و حالات خمش باند Si–O–Si مرتبط باشد. حضور کوارتز در این نمونه توسط پیوند شانه FTIR در 796-777 cm¯¹ نشان داده می شود (. Klinkenberg و همکاران 2006؛ Yang و همکاران 2010).
ویژگی های جذب
به منظور بررسی اثر مقدار بنتونیت در حذف کادمیم از حلال، آزمایشات با وزن 5.00–60.00 g/L, ، با غلظت مشابه (100000 واحد در میلیون ) در 25 سانتیگراد، با سرعت هم زدن 500 دور در دقیقه، و اندازه ذرات از 150- میکرومتر انجام شد. شکل تکمیلی 3، نتایج حاصل از جذب Cd را با مقادیر مختلف بنتونیت ارائه می دهد. واضح است که درصد جذب تابعی از جرم بنتونیت است. افزایش نسبت جاذب به مایع سبب افزایش درصد جذب به حداکثر مقدار 50.0 گرم / لیتر از بنتونیت، همانند مقدار سایت های در دسترس برای تبادل یونی افزایش یافته با افزایش جرم بنتونیت می شود (Abollino و همکاران، 2003) . (Bentouami و Ouali 2006؛ Hamidpour و همکاران 2010؛ Purna و همکاران 2006؛ Zhao و همکاران 2011) حداکثر مقدار کادمیم حذف شده از حلال برای 1.00 گرم بنتونیت 160.00 میلی گرم بود که در مقایسه با دیگر مقدارهای گزارش قابل توجه بود.
Abstract
Bentonite from the Birjand area of Iran was characterized by X-ray diffraction, X-ray fluorescence, and Fourier transform infrared spectroscopy. The removal of cadmium from aqueous solution by this bentonite was investigated as a function of conditions such as contact time, metal concentrations, pH, stirring speed, temperature, particle size, and amount of bentonite. The adsorption isotherm was studied with different models: the Freundlich and Dubinin–Radushkevich models had the highest correlation coefficients, 0.9922 and 0.9988, respectively. The corresponding Langmuir model indicates a maximum adsorption capacity of 13.50 mg/g. Firstorder, pseudo-second-order, and intra-particle diffusion equations were used to study the mechanism of adsorption; the experimental data fit well with pseudo-second-order kinetics. Thermodynamic parameters of adsorption were calculated at temperatures of 293, 303, 313, and 323 K, and indicated that the Cd adsorption was exothermic and spontaneous.
Introduction
The presence of cadmium ions in industrial wastes affects human and aquatic lives (Godt et al. 2006; Lavelle 1995; Sharma 1995). Hence, many processes for Cd removal have been studied (Bedoui et al. 2008; Jianru et al. 2007; Lodeiro et al. 2006; Namasivayam and Ranganathan 1995; Wu and Xiong 2003), and various types of bentonite have been used for the removal of metals and other pollutants (Babel and Kurniawan 2003; Koswojo et al. 2010; Li et al. 2011). The ability to absorb metals such as Cd, Zn, Fe, Hg, Cr, Cu, Mn, and Pb onto bentonite is well recognized (Chen et al. 2011; Inglezakis et al. 2007; Karapinar and Donat 2009; Vieira et al. 2010; Wang et al. 2011) and many studies have focused on optimum conditions, thermodynamics, isotherm models, and kinetics for removal of Cd using bentonite (Hamidpour et al. 2010; Huang et al. 2011; Purna et al. 2006; Zhao et al. 2011). The maximum removal of Cd onto raw and modified bentonite is summarized in Table 1, which shows that the best Cd adsorption belongs to a modified bentonite with an intercalation of 8-hydroxyquinolinium (Bentouami and Ouali 2006). However, the suitability of Iranian bentonite for Cd adsorption has not been characterized; this study was conducted to investigate its effectiveness and key factors involved in the adsorption process.
Materials and Methods A representative sample of bentonite from the Birjand area in southeastern Iran was used without any chemical pretreatment. The sample was ground and sieved by ASTM standard sieves to obtain the nominal particle size fractions of -600 to ?425, -425 to ?300, -300 to ?150, and -150 lm in diameter. X-ray diffraction (XRD) and X-ray fluorescence (XRF) were used to determine the mineralogy of the sample and its elemental analysis, respectively. XRD spectra and XRF were obtained using a Philips X-ray diffractometer 1140 (a = 1.54 A, 40 kV, 30 mA, calibrated with Si-standard) and a Philips X-ray diffractometer Xunique II (80 kV, 40 mA, calibrated with a Si-standard), respectively. The XRD of the sample is shown in Fig. 1, and the elemental analysis of the sample is shown in Table 1. This result indicated that the main mineral of the sample is montmorillonite. All chemical compounds were purchased from Merck and used without further purification.
Infrared spectra from 4,000 to 400 cm-1 were recorded on a Shimadzu 470 FT-IR instrument, using KBr pellets. Fourier transform infrared (FTIR) spectroscopy has been used for chemical functional groups. The Cd concentration after adsorption was determined using a Unicom 939 atomic absorption (AA) spectrometer. The Cd adsorption was calculated by the amount of Cd in solution.
The Cd adsorption experiments were carried out using batch equilibrium. All of the adsorption experiments were conducted in a 250.0 mL glass reactor using a magnetic stirrer for mixing at ambient temperature. In this study, the influence of the parameters, such as mass of bentonite from 5.00 to 60.00 g/L, particle size from -150 to -600 lm, initial Cd concentration from 50.0 to 2,000.0 ppm, contact time from 15 to 180 min, and stirring speed from 400 to 900 rpm were investigated, and the optimized conditions for maximizing Cd adsorption were determined. All other parameters were held constant for the investigation of each parameter in each test. The adsorption isotherms models of Langmuir, Freundlich, Temkin, and Dubinin–Radushkevich (D–R) were studied using 5 g of bentonite added to 100 mL of solution containing different concentrations of Cd, ranging from 50 to 2,000 ppm. All of the solutions were immediately filtered after each test.
For the kinetic investigation, 5 g of bentonite was mixed with 100 mL of Cd at various concentrations of 100.00, 250.00, 500.00, 750.00, 1,000.00, and 1,500.0 mg/L. Each batch test was conducted at various time intervals to determine the period required to reach the adsorption equilibrium and maximum removal of Cd. For the thermodynamic investigation, 5.00 g of bentonite was added to 100 mL of Cd solution at concentrations of 100.0 mg/L and the amount of removed Cd was determined at various temperatures (293, 303, 313, and 323 K). The amount of Cd adsorbed onto the bentonite was determined from the difference between the initial and remaining concentrations of Cd in solution after adsorption.
Result and Discussion
Characterization of the Bentonite
The mineralogical study indicated that quartz, oligoclase, gypsum, montmorillonite, and illite were the main constituents of this sample (Supplementary Fig. 1; supplementary files appear with the on-line version of this paper). The diffraction peaks at 8.9329, 19.8985, and 26.6978 (2O–) correspond to planes (001), (002), and (003), although plane (001) overlapped with the illite diffraction peak. The bentonite contains little illite; the main impurity in this sample was quartz, which is observed in the XRD pattern with the main diffraction peak at 27.7311 (2O–) (Caglar et al. 2009). The main mineral is montmorillonite; the presence of iron likely indicates that some adsorption has already taken place (Supplementary Table 1).
Infrared data are usually used to identify solid-state structures and functional groups of clays. Presence of two stretching bands at 3,627.54 and 3,432.54 cm-1 indicate O–H bond linkage (Supplementary Fig. 2). The stretching band at 3,627 cm-1 is due to the hydroxyl linkage of the bentonite structure and the board band at 3,432 cm-1 indicates the presence of water molecule in the structure, due to hydrogen bonding between hydrogen and oxygen of different water molecules (Wang et al. 2009). The bending vibration band of H–O–H in the water molecule of bentonite is observed at 1,635 cm-1 . The strong and broad band at 1,040 cm-1 can be attributed to Si–O of stretching vibration in the Si–O–Si functional group in tetrahedral sheets, for the montmorillonite structure (Wang et al. 2011). Two bending vibration bands at 467 and 519 cm-1 represent Si–O–Al and Si–O–Si bonds, respectively. The vibration band at 693 cm-1 and its small shoulder band (with a lower intensity, which is not assigned in Supplementary Fig. 2) can be related to the deformation and bending modes of the Si–O–Si bond. The presence of quartz in this sample is indicated by the FTIR shoulder bonding at 796–777 cm-1 (Klinkenberg et al. 2006; Yang et al. 2010).
Adsorption Characteristics
In order to study the effect of bentonite quantity on the removal of Cd from solution, experiments were conducted with weights of 5.00–60.00 g/L, with the same concentration (1,000.00 ppm Cd2?) at 25 C, a stirring speed of 500 rpm, and a particle size of -150 lm. Supplementary Fig. 3 presents the results of Cd adsorption with different bentonite values. It is obvious that the adsorption percentage is a function of bentonite mass. The increase in adsorbent to liquid ratio caused the percentage of adsorption to increase, to a maximum value at 50.0 g/L of bentonite, as the amount of available sites for ion exchange increased with the increasing mass of bentonite (Abollino et al. 2003). The maximum value of Cd removed from solution for 1.00 g of bentonite was 160.00 mg, which is considerable compared with other reported values (Bentouami and Ouali 2006; Hamidpour et al.
چکیده
مقدمه
مواد و روش ها
نتایج و بحث
مشخصه بنتونیت
ویژگی های جذب
اثر اندازه ذرات بر روی کادمیوم جذب
اثر سرعت هم زدن در جذب کادمیوم
اثر غلظت اولیه کادمیم (II) بر حذف کادمیم
اثر pH بر جذب کادمیم
مدل های خط همدمای جذب
خط همدمای Langmuir
خط همدمای Freundlich
خط همدمای Temkin
خط همدمای Dubinin-Radushkevich (D-R)
بررسی مدل خط همدمای جذب کادمیم بر روی بنتونیت
سینتیک جذب یون های کادمیم بر روی بنتونیت ایران
معادله شبه مرتبه اول
معادله شبه مرتبه دوم
معادله انتشار داخل ذرات
بررسی جذب سطحی مدل سینتیکی کادمیم بر روی بنتونیت
مطالعه ترمودینامیکی
نتیجه گیری
Abstract
Introduction
Materials and Methods
Result and Discussion
Characterization of the Bentonite
Adsorption Characteristics
Effect of Particle Size on Cadmium Adsorption
Effect of Stirring Speed on Cadmium Adsorption
Effect of Initial Cd(II) Concentration on Cd Removal
Effect of pH on Adsorption of Cd
Adsorption Isotherm Models
Langmuir Isotherm
Freundlich Isotherm
Temkin Isotherm
Dubinin–Radushkevich (D–R) Isotherm
Evaluation of Adsorption Isotherm Models of Cd
onto Bentonite
Adsorption Kinetics of Cd Ions onto Iranian Bentonite
Pseudo-first Order Equation
Pseudo-second-Order Equation
Intra-particle Diffusion Equation
Evaluation of Adsorption Kinetic Model of Cd
onto Bentonite
Thermodynamic Study
Conclusions
