
دانلود رایگان مقاله القاء آپوپتوز در سلول های سرطانی HeLa توسط سنتز نانوذرات کیتوزان
چکیده
ترکیبات گیاهی طبیعی به عنوان راهکار درمان جایگزین در درمان سرطان به طور گسترده ای معرفی شده اند. علیرغم فعالیت ضد سرطانی کورکومین، کاربرد بالینی آن به دلیل حلالیت آب کم و کمبود بیوپسی بودن محدود شده است. در این مطالعه، یک روش جدید برای کمک به اولتراسونیک برای سنتز نانو ذرات تراتلیوفسفات کیتوزان-آلژینات سدیم تربلی پلی فسفات NP-CS-ALG-STPP) ) از کورکومین طراحی شده است. علاوه بر این، اثرات ضد تومور نیکل کورکومین بارگذاری شده در محیط آزمایشگاهی مورد بررسی قرار گرفت. برای مشخص کردن خصوصیات NP ها از میکروسکوپ الکترونی (FE-SEM) و میکروسکوپ نیروی اتمی (AFM) استفاده شد. فعالیت ضد تومور NP های پرشده با کورکومین با استفاده از MTT و واکنش زنجیره ای پلی مراز در زمان واقعی (qRT-PCR) مورد بررسی قرار گرفت. داده های FE-SEM و AFM مورفولوژی کروی را نشان دادند و اندازه متوسط NP ها 50 نانومتر بود. آزمایش سیتوتوکسی سیتی درون آزمایشگاهی نشان داد که کورکومین CS-ALG-STPP NP دارای فعالیت ضد توموری قابل توجهی در مقایسه با کورکومین آزاد بود. تجزیه و تحلیل سطح حالت ژن نشان داد که NP های کورکومین به طور قابل توجهی حالت ژن آپوپتوزی را افزایش داد. به طور خلاصه، نتایج ما نشان می دهد که پروتئین های کرکومین به طور قابل توجهی تکثیر را سرکوب کرده و القاء آپوپتوز را در سلول های سرطانی اپیتلیویید سرویکس انسانی ایجاد می کند که ممکن است به عنوان یک راهکار جایگزین برای درمان سرطان در نظر گرفته شود.
مقدمه
کورکومین یک پلی فنول زرد مشتق از ریزوم زردچوبه (Curcuma longa) است. 1 تعداد بیشتری از مطالعات نشان داده اند که کورکومین دارای خواص مفید مانند آنتی باکتریال، آنتی اکسیدان 2،3، 4 ضد آمیلوئید، 5 ضد التهابی، 6 ضد میکروبی 7 و اثرات بهبود زخم می باشد.8 مطالعات قبلی نشان داد که کورکومین به تنهایی یا در ترکیب با سایر داروهای ضد سرطان دارای فعالیت ضد تومور قوی در سلول های مختلف تومور شامل کبد، 9 پروستات، 10 تخمدان، 11 پستان، 12 پانکراس، 13 و سرطان معده است. 14 علاوه بر این، گزارش شده است که کورکومین اثرات قابل ملاحظه ای بر مسیر های سیگنالینگ (علامت دهی) سرطان زایی از طریق مهار آنژیوژنز، فعال سازی مرگ سلولی 13 ، 15 و تحریک متوقف شدن چرخه سلولی دارد. [16] علی رغم فعالیت امیدوار کننده ضد تومور کورکومین، کاربرد بالینی آن به علت حذف سیستمیک سریع و حلالیت آب پایین است که قابلیت زیستی این ترکیب زیست فعال را محدود می سازد. برای غلبه بر این محدودیت ها روش های مختلفی برای بهبود حلالیت کورکومین از جمله کپسوله کردن کورکومین در لیپوزوم، 19 دندریمر، 20 نانوذرات پلیمری (NP ها)21، نانوژل 22 سیکلوکودکسترین، 23 و میکروسفور زیست تخریب پذیر مورد استفاده قرار گرفته اند. به دلیل ماهیت هیدروفوب کورکومین، بسته شدن آن با پلیمرهای زیست سازگارو زیست تخریب پذیر به عنوان یک استراتژی امیدوار کننده برای درمان سرطان معرفی شده است. آلژینات (ALG) و کیتوزان (CS) دو پلیمر طبیعی هستند که دارای کاربرد فراوان داروئی و زیست پزشکی می باشند. 25 ALG یک پلی ساکارید خطی محلول در آب است که از جلبک دریایی قهوه ای استخراج شده و NPG های ALG را می توان با افزودن تراتو پلی فسفات سدیم (STPP) و محلول پلی کاتیوتیک بدست آورد، که باعث تشکیل ترکیب پلی الکترولیتی می گردد.26. به علت کمبود ایمنی و خواص غیر سمی CS، آن به عنوان یک پلیمتیک کاتیونی انتخاب شده است. 27 شواهد فراوانی نشان داده است که NPهای کورکومین را می توان با استفاده از CS28،29 یا ALG.30،31 تهیه کرد. علاوه بر این، یک مطالعه قبلی نشان داد که کورکومین را می توان با ALG، CS و کامپوزیت پلورونیک کپسوله کرد که می تواند فعالیت ضد سرطانی کورکومین را به طور قابل توجهی افزایش دهد .32 علاوه بر این، کورکومین به عنوان یک اسفنج CS-ALG برای بهبود خواص زخم ترکیب شده است .34،34 اخیرا، NPهای کورکومین با استفاده از CS، ALG، TPP و کلرید کلسیم تولید شده است .35 با توجه به ضرورت یافتن سیستم جایگزینی دارو برای درمان سرطان، مطالعه حاضر روش جدیدی را برای بارگذاری و ترکیب کورکومین بر روی CS، ALG و STPP NP توسط یک روش اولتراسونیک کمکی شرح می دهد. سپس، تأثیر نانوذرات کورکومین بر تکثیر و آپوپتوز در سلولهای سرطانی سرطان اپیتلیویید گردن انسان (HeLa) مورد بررسی قرار گرفت.
مواد و روش ها
مواد شیمیایی
پودر کورکومین ازشرکت مرک در Darmstadtآلمان خریداری شد. CS و ALG از شرکت سیگما آلدریچ در سنت لوییز امریکا بدست آمد. STPP از شرکت Daejung، Sasang-gu، در بوسان کره جنوبی تهیه شد. مواد محیط کشت و MTT به ترتیب از ATOCEL در گراز اتریش و آلفا آئسار (Ward Hill، MA، USA ) خریداری شده است.
آماده سازی NPهای CS -ALG –STPP ترکیب شده با کرکومین
طبق گزارش Caetano وهمکاران، NPهای CS -ALG –STPP با برخی از اصلاحات تهیه شده است. 36 میلی گرم CS در 1٪ اسید استیک به دست می آید تا با غلظت مغناطیسی به غلظت نهایی 1 میلی گرم بر میلی لیتر برسد و pH آن در 4.9تنظیم می شود . محلول CS با استفاده از اشعه ماوراء بنفش (Bandelin، Berlin، (Germany به مدت 1 ساعت هم زده شد. سپس پودر کرکومین در مقدار کمی اتانول حل شد و 1 میلی لیتر از محلول آن (1 میلی گرم در میلی لیتر در اتانول) در محلول CS با تکان دادن اضافه شد. 5 میلی گرم ALG در آب مقطر حل شد، و pH سوسپانسیون تا 4.6توسط (HCl (0.5 M تنظیم شد. ALG به این محلول به صورت قطره ای اضافه شد و سپس با استفاده از یک سرنگ انسولین (سرعت جریان: 1 میلی لیتر در دقیقه) ، STPP (0.13٪ w / v) در آب دیئونیزه فوق خالص به مدت 120 دقیقه هم زده شد. مخلوط حاصل جمع آوری شد و با 10 درصد اتانول و آب بوسیله سانتریفوژ با 14000 دور در دقیقه برای مدت 30 دقیقه در دمای 4 درجه سانتیگراد شسته شد.
ویژگی های NP (نانو ذرات)
مورفولوژی سطح و توزیع اندازه ذرات آلکالین - هیدروکسید کربن با استفاده از میکروسکوپ الکترونیک با اسکن انتشار میدانی(FE-SEM، Mira 3 XMU، TESCAN، Brno، جمهوری چک)، میکروسکوپ نیروی اتمی (AFM، Easyscan 2 Flex، Liestal ، سوئیس) و طیف سنجی مادون قرمز فوریه (FT-IR) تعیین گردید. طیف سنجی FT-IR ازNPهای ALG-CS-STPP ترکیبی با کورکومین، با استفاده از اسپکتروفتومتر FT-IR (Vector 22 FT-IR، Bruker Optik GmbH، Ettlingen، آلمان) به دست آمد.
بازده کپسوله سازی
برای تعیین میزان جذب کورکومین، تجزیه و تحلیل کروماتوگرافی مایع با عملکرد بالا (HPLC) (Knauer؛ Smartline، Berlin، Germany) انجام شد. همانطور که قبلا ذکر شد، در مرحله نهایی آماده سازی NP، محلول کورکومین-CS-ALG-STPP سانتریفیوژ شد و محلول فریز شده جمع آوری گردید. پس از شستن مخلوط با اتانول، سطح سوپرمنات جمع آوری شد و مقدار کورکومین باقی مانده مورد بررسی قرار گرفت. علاوه بر این، 1 میلیگرم نانوذرات خشک شده در هوا در 1 میلی لیتر آب حل شده و کورکومین بر روی نانوذرات با استفاده از استونیترول استخراج شده است. ستون HPLC (C18 Eurospher، Knauer، Smartline، Berlin، Germany ) و فاز متحرک مخلوطی از استونیتریل و آب در نسبت 90:10 (V / V ) بود. سرعت جریان فاز متحرک 1 میلی لیتر در دقیقه بود و این حلال با استفاده از آشکارگر ماوراء بنفش (UV) در طول موج 425 نانومتر تشخیص داده شد.
مطالعات آزاد سازی در شرایط آزمایشگاهی
رها سازی آزمايشگاهی کورکومين از نانوذرات بر اساس یک گزارش قبلی انجام شد. به طور خلاصه، 5 میلی گرم از نانوذرات ترکیبی با کورکومین خشک شده در هوا در 32 میلی لیتر PBS pH 7.4) ) پراکنده و توزیع شد و محلول حاصل تقسیم و در 16 لوله میکرو فیف (هر 2 میلی لیتر) نگهداری شد. در فواصل زمانی 0، 1، 2، 3، 4، 5 و 24 ساعت، محلول در 10000 دور در دقیقه به مدت 10 دقیقه سانتریفوژ شد. کورکومین آزاد شده در 2 میلی لیتر اتانول آزاد حل شد و جذب با استفاده از اشعه ماوراء بنفش (SQ4802؛ UNICO، Dayton، NJ، USA ) با طول موج 425 نانومتر اندازه گیری شد.
مطالعه ایزوترم جذب
آزمایشات ایزوترم با توجه به گزارش قبلی چنگ و همکاران 38 انجام شد. به طور خلاصه، غلظت های مختلف کورکومین (0.1، 0.15، 0.2، 0.25 و 0.3 میلی گرم / میلی لیتر) با NP-CS-ALG-STPP مخلوط شدند و نتیجه مخلوط به مدت 24 ساعت در دمای 25 درجه سانتی گراد به طور مداوم تکان داده شد.
Abstract
Natural herbal compounds have been widely introduced as an alternative therapeutic approach in cancer therapy. Despite potent anticancer activity of curcumin, its clinical application has been limited because of low water solubility and resulting poor bioavailability. In this study, we designed a novel ultrasonic-assisted method for the synthesis of curcumin-loaded chitosan–alginate–sodium tripolyphosphate nanoparticles (CS-ALG-STPP NPs). Furthermore, antitumor effect of curcumin-loaded NPs was evaluated in vitro. Field emission scanning electron microscopy (FE-SEM) and atomic force microscopy (AFM) were used to characterize the properties of NPs. Antitumor activity of curcumin-loaded NPs was assessed by using MTT and quantitative real-time polymerase chain reaction (qRT-PCR). FE-SEM and AFM data revealed the spherical morphology, and the average size of NPs was ,50 nm. In vitro cytotoxicity assay suggested that curcumin-loaded CS-ALG-STPP NPs displayed significant antitumor activity compared with the free curcumin. Gene expression level analyses showed that curcumin NPs significantly increased the apoptotic gene expression. Collectively, our results suggest that curcumin-loaded NPs significantly suppressed proliferation and promoted the induction of apoptosis in human cervical epithelioid carcinoma cancer cells, which might be regarded as an effective alternative strategy for cancer therapy.
Introduction
Curcumin is a yellow polyphenol derived from the turmeric rhizome (Curcuma longa).1 A growing number of studies have indicated that curcumin has several beneficial properties such as antitumor,2,3 antioxidant,4 anti-amyloid,5 anti-inflammatory,6 antimicrobial,7 and wound healing effects.8 Previous studies suggested that curcumin alone or in combination with other anticancer drugs possesses potent antitumor activity on different tumor cell lines including hepatic,9 prostatic,10 ovarian,11 breast,12 pancreatic,13 and gastric carcinomas.14 Furthermore, it has been reported that curcumin has significant effects on carcinogenesis signaling pathways through angiogenesis inhibition,13 cell death activation,15 and cell cycle arrest induction.16 Despite promising antitumor activity of curcumin, its clinical application has been hampered due to rapid systemic elimination and low aqueous solubility that limits the bioavailability of this bioactive compound.17,18 To overcome these limitations, different approaches have been used to improve curcumin solubility including the encapsulation of curcumin in liposome,19 dendrimers,20 polymeric nanoparticles (NPs),21 nanogel,22 cyclodextrin,23 and biodegradable microsphere.24 Because of the hydrophobic nature of curcumin, its encapsulation by natural biocompatible and biodegradable polymers has been introduced as a promising strategy for cancer therapy. Alginate (ALG) and chitosan (CS) are two natural biopolymers that have numerous pharmaceutical and biomedical applications.25 ALG is a water-soluble linear polysaccharide extracted from brown seaweed, and ALG NPs can be obtained by adding sodium tripolyphosphate (STPP) and polycationic solution, resulting in the formation of polyelectrolyte complex.26 Because of low immunogenicity and nontoxic properties of CS, it has been selected as an alternative cationic polymer.27 Ample evidence has shown that curcumin NPs can be prepared by using CS28,29 or ALG.30,31 In addition, a previous study suggested that curcumin can be encapsulated with ALG, CS, and pluronic composite, which could significantly enhance the anticancer activity of curcumin.32 Furthermore, curcumin has been incorporated into CS-ALG sponge to improve its wound healing property.33,34 More recently, curcumin NPs have been produced by using CS, ALG, TPP, and calcium chloride.35 Regarding the necessity of finding an alternative drug delivery system for cancer therapy, the present study describes a new approach for loading curcumin onto CS, ALG, and STPP NPs by an ultrasonic-assisted method. Then, the effects of curcumin-loaded NPs on proliferation and apoptosis were investigated in human cervical epithelioid carcinoma (HeLa) cancer cell lines.
Materials and methods
Chemicals
Curcumin powder was purchased from Merck Company, Darmstadt, Germany. CS and ALG were obtained from Sigma-Aldrich (St Louis, MO, USA). STPP was prepared from Daejung, Sasang-gu, Busan, South Korea. Culture medium materials and MTT were purchased from ATOCEL (Graz, Austria) and Alfa Aesar (Ward Hill, MA, USA), respectively.
Preparation of curcumin-loaded CS-ALGSTPP NPs
CS-ALG-STPP NPs were prepared according to Caetano et al’s report, with some modifications.36 Ten milligram of CS was dissolved in 1% acetic acid to reach a final concentration of 1 mg/mL by magnetic stirring, and its pH was adjusted to 4.9. CS solution was stirred by ultrasonic irradiation (Bandelin, Berlin, Germany) for 1 hour. Curcumin powder was then dissolved in a small quantity of ethanol, and 1 mL of its solution (1 mg/mL in ethanol) was added in CS solution with stirring; 5 mg of ALG was dissolved in distilled water, and pH of the suspension was adjusted to 4.6 by HCl (0.5 M). ALG was added dropwise to this solution, followed by dropwise addition of STPP (0.13% w/v in ultrapure deionized water) using an insulin syringe (flow rate: 1 mL/min) under high-speed stirring for 120 minutes. The resulting mixture was collected and washed with 10% ethanol and water by centrifugation at 14,000 rpm for 30 minutes at 4°C.
NP characterization
The surface morphology and size distribution of curcuminloaded ALG-CS-STPP NPs were characterized by field emission scanning electron microscopy (FE-SEM; Mira 3 XMU; TESCAN, Brno, Czech Republic), atomic force microscopy (AFM; Easyscan 2 Flex, Liestal, Switzerland), and Fourier transform infrared (FT-IR) spectroscopy. The FT-IR spectroscopy of curcumin, ALG-CS-STPP NPs, and curcumin-loaded NPs were obtained by using FT-IR spectrophotometer (Vector 22 FT-IR; Bruker Optik GmbH, Ettlingen, Germany).
Encapsulation efficiency
To determine the amount of curcumin entrapment, highperformance liquid chromatography (HPLC) analysis (Knauer; Smartline, Berlin, Germany) was performed. As we mentioned previously, at the final step of NP preparation, curcumin–CS-ALG-STPP solution was centrifuged, and the decanted solution was collected. After washing the mixture with ethanol, supernatant was collected, and the amount of remaining curcumin was evaluated. In addition, 1 mg of air-dried NPs was dissolved in 1 mL of water, and curcumin loaded onto NPs has been extracted using acetonitrile. The HPLC column was C18 (Eurospher, Knauer; Smartline, Berlin, Germany), and the mobile phase was a mixture of acetonitrile and water in a ratio of 90:10 (v/v). The flow rate of the mobile phase was 1 mL/min, and the eluent was detected by ultraviolet (UV) detector at a wave length of 425 nm.Area under the peaks was measured by using EZChrom software, and then, the amount of curcumin was calculated using a standard curve.
In vitro release studies
The in vitro release of curcumin from NPs was carried out according to a previous report.32 Briefly, 5 mg of airdried curcumin-loaded NPs was dispersed in 32 mL PBS (pH 7.4), and the resulting solution was divided and kept in 16 microfuge tubes (each 2 mL). At time intervals of 0, 1, 2, 3, 4, 5, and 24 hours, the solution was centrifuged at 10,000 rpm for 10 minutes. The released curcumin was dissolved in 2 mL absolute ethanol, and the absorbance was measured using UV spectrophotometer (SQ4802; UNICO, Dayton, NJ, USA) at a wavelength of 425 nm.
Adsorption isotherm study
Isotherm experiments were performed according to a previous report by Cheng et al.38 In brief, different concentrations of curcumin (0.1, 0.15, 0.2, 0.25, and 0.3 mg/mL) were mixed with CS-ALG-STPP NPs, and the resulting mixture was continuously shaken for 24 hours at 25°C.
چکیده
مقدمه
مواد و روش ها
مواد شیمیایی
آماده سازی NPهای CS -ALG –STPP ترکیب شده با کرکومین
ویژگی های NP (نانو ذرات)
بازده کپسوله سازی
مطالعات آزاد سازی در شرایط آزمایشگاهی
مطالعه ایزوترم جذب
تست های کشت سلولی
رنگ آمیزی هسته ای
واکنش زنجیره ای پلیمراز در زمان واقعی کمی (qRT-PCR)
تحلیل آماری
نتایج
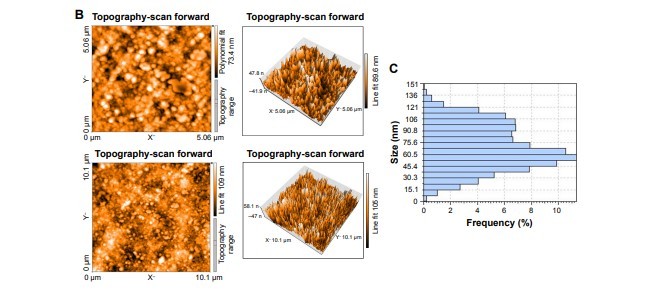
خواص نانوذرات CS -ALG -STPP NPC حاوی کورکومین
تجزیه و تحلیل طیف سنجی FT-IR
راندمان جذب
انتشار کورکومین در محیط آزمایشگاهی از CS -ALG -STPP NP
جذب کورکومین و نانوذرات CS -ALG -STPP
آزمایشات درون آزمایشگاهی
اثر نانوذرات کرکومین بر حالت ژن مربوط به آپوپتوز
بحث
نتیجه گیری
منابع
Abstract
Introduction
Materials and methods
Chemicals
Preparation of curcumin-loaded CS-ALGSTPP NPs
NP characterization
Encapsulation efficiency
In vitro release studies
Adsorption isotherm study
Cell culture assays
Nuclear staining
Quantitative real-time polymerase chain reaction (qRT-PCR)
Statistical analysis
Results
Curcumin-loaded CS-ALG-STPP NP properties
FT-IR spectroscopy analysis
Entrapment efficiency
In vitro release of curcumin from CS-ALG-STPP NPs
Adsorption affinity of curcumin and CS-ALG-STPP NPs
In vitro assays
Effect of curcumin-loaded NPs on apoptosis-related gene expression
Discussion
Conclusion
References
