
دانلود رایگان مقاله هدف قرار دادن سلول های سرطان پروستات به وسیله نانوذرات طلا
چکیده
آنتی ژن غشاء مربوط به پروستات (PSMA) نشانگر زیستی قابل توجهی برای فرایندهای تشخیصی و درمانی در سرطان پروستات است. ذرات طلایی نانو بستر جذابی از مواد نانو را برای ترکیب متنوعی از عوامل هدف گیر، تصویربرداری و سیتوتوکسیک در دستگاه واحدی برای تحقیقات زیست پزشکی فراهم می آورد. در این بررسی، ما تولید و ارزیابی اولین سامانه AuNP را نشان می دهیم که به وسیله مهارکننده پپتیدومیمتیک فوسفورامیدیت مولکولی کوچک برای تحویل هدف گرفته به سمت سلول های سرطان پروستات نمایانگر PSMA عملیاتی شده است. رویکرد کلی دربرگیرنده گُشن گیری AuNP های دارای پوشش استرپتاویدین با مهارکننده PSMA مرتبط با بیوتین برای ایجاد AuNPهای هدف گیری شده به سمت PSMA است. در ارزیابی های آزمایشگاهی، این AuNP های هدف گیری شده برای تعیین اتصال وابسته به زمان و با واسطه PSMA به سلول های LNCaP مثبت PSMA استفاده شدند. AuNP های هدف گیرنده به سمت PSMA اتصالات بیشتر و گزینشی تری به سلول های LNCaP را در مقایسه با AuNPهای هدف گیری نشده گواه نشان دادند، که نشانگر ممکن بودن این رویکرد است.
سرطان پروستات دومین سرطان شایعی است که در مردان تشخیص داده شده و دومین عامل مرگ در مردان سرطانی ایالات متحده است. از طریق روش های استاندارد می توان تومورهای پروستات را در مراحل اولیه با موفقیت درمان نمود. با این حال، سرطان پروستات متاستاتیک در مراحل پیشرفته معمولا احتمال درمان کمتری دارد که این مسئله بر لزوم توسعه روش های جدید برای بهبود عواقب ناشی از بیماری را تأکید می کند. آنتی ژن غشاء مربوط به پروستات یک گلیکوپروتئین غشاء نوع 2 است و به خاطر نمود منحصر بفرد در سلولهای سرطانی متاستاتیک و اولیه و تمایلش برای درونی کردن لیگاندهای هدف گیرنده دارای ویژگی های مطلوبی به عنوان هدف نشانگر آنزیمی است. از میان ساختاری شیمیایی مورد استفاده برای هرف گیری PSMA در تحقیقات مربوط به سرطان پروستات، گروه ما مهارکننده های فوسفورامیدیت پپتیدومیمیتیک PSMA را برای تحویل ردیفی از عوامل درمانی و تصویرگیرنده را برای سلولهای سرطانی در محیط آزمایشگاهی و داخل بدن توسعه داد. در میان آنها، هسته مهارکننده CTT54 به خاطر وابستگی بالا، حالت اتصال نسبتا غیرقابل برگشت، جذب سریع، و درونی سازی در سلول های سرطانی مثبت PSMA به عنوان مولکول هدف گیرنده PSMA به طور ویژه ای موثر است.
ذرات نانو به خاطر ویژگی های فارماکوکینتیک، قابلیت انجام چندین فرایند، و توانایی بارگیری زیاد نمایانگر فناوری نوظهوری در فرایندهای پزشکی هستند. به خاطر این ویژگی ها، ذرات نانو بستری های جذابی برای توسعه عوامل چندمدلی هستند. ذرات نانو طلایی (AuNP) به خصوص حاوی خصوصیات فیزیکی و شیمیایی متمایز و قابل کنترلی هستند که نسبت به سایر بسترهای ذرات نانو امتیازات بیشتری دارند. هسته طلایی سازگار با محیط زیستی بوده و به طور مستقیم در کاربردهای تصویربرداری و درمانی استفاده شده است. علاوه بر این، می توان سطح طلایی را به وسیله دهندگان نرم تغییر داد که توسط مولکول های گزارش دهنده، درمانی، هدف گیرنده یا مولکول های تثبیت بیولوژیکی کنترل شده اند تا ابزارهای چندکاره ای را برای استفاده های آزمایشگاهی و درون بدن ایجاد نماید.
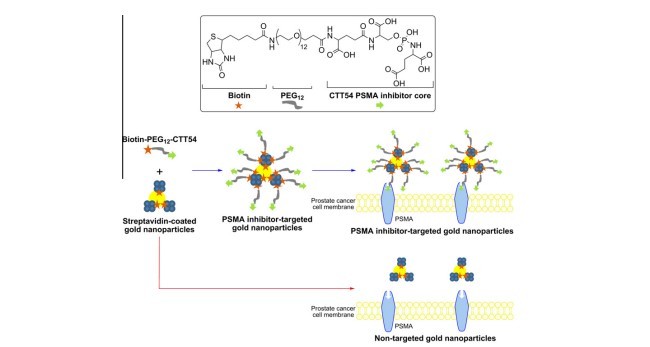
ترکیب بسترهای نانوذرات با لیگاندهای نمایانگرهای زیستی سطح سلولهای تومور ساختار امیدوارکننده ای برای تحقق تحویل گزینشی و جذب در سلول های هدف می باشد. با توجه به هدف گیری PSMA، چندین نوع نانوذرات با انواع مختلف عوامل هدف گیری تجهیز شده اند که نشان دهنده کاربری این نشانگرهای زیستی برای کاربردهای سلول های سرطانی آزمایشگاهی می باشد. با وجودی که تحویل هدف گیری شده به سمت PSMA AuNPها پیش از این با استفاده از آپتامرها و آنتی بادی های ضد PSMA انجام شده است، به کارگیری AuNPها با مهارکننده های مولکولی کوچک پیش از این گزارش نشده است. به کارگیری مولکول های کوچک ممکن است مزایای زیادی نسبت به بسترهای بزرگ تر در ایجاد AuNpهای هدف، شامل هزینه های پایین ایمنی و مقیاس بالا، داشته باشد. در مقایسه با آنتی بادی ها، مولکول های کوچک می توانند با سطوح نانوذرات در جهات قابل کنترل جفت شوند که برای هدف زیست شیمیایی وابستگی را مورد مصالحه قرار نمی دهند. علاوه بر این، آنتی بادی های مرتبط با آنتی ژن های سطحی مانعی را برای اتصال آتی آنتی بادی ها در آنتی ژن های سطحی پیرامون ایجاد می کنند و ممکن است تا حدی تأثیر بسترهای نانوذرات هدف گیری شده به سمت آنتی بادی چندمنظوره را محدود می کنند. هدف اصلی این تحقیق، بررسی امکان استفاده از مهارکننده PSMA پپتیدومیمتیک فوسفورامیدیت مولکولی کوچک برای واسطه تحویل AuNPها به سلولهای سرطانی می باشد. اولین نسل بستر AuNP هدف گیری شده به سمت PSMA که برای این کار توسعه یافته اند، از اتصال سطحی بیوتین-استرتاویدین استفاده کرد تا نانوذرات را فعال سازد. ما اخیرا از مهارکننده PSMA بیوتینی (CTT54) برای ارتقا تحویل با واسطه PSMA برای سایر ترکیبات ماکرومولکولی با سلولهای PSMA+ LNCaP استفاده کرده ایم. برای تعمیم این شیوه کار قبلی در سیستم نانودرات، AuNPهای دارای پوشش استرپتاویدین با CTT54 بیوتینی در مطالعه فعلی مجهز شدند.
Abstract
Prostate-specific membrane antigen (PSMA) is a notable biomarker for diagnostic and therapeutic applications in prostate cancer. Gold nanoparticles (AuNPs) provide an attractive nanomaterial platform for combining a variety of targeting, imaging, and cytotoxic agents into a unified device for biomedical research. In this study, we present the generation and evaluation of the first AuNP system functionalized with a small molecule phosphoramidate peptidomimetic inhibitor for the targeted delivery to PSMAexpressing prostate cancer cells. The general approach involved the conjugation of streptavidin-coated AuNPs with a biotin-linked PSMA inhibitor (CTT54) to generate PSMA-targeted AuNPs. In vitro evaluations of these targeted AuNPs were conducted to determine PSMA-mediated and time-dependent binding to PSMA-positive LNCaP cells. The PSMA-targeted AuNPs exhibited significantly higher and selective binding to LNCaP cells compared to control non-targeted AuNPs, thus demonstrating the feasibility of this approach.
Prostate cancer is the second most common cancer diagnosed in men globally1 and remains the second leading cause of cancer mortality in men in the United States.2 Early stage primary prostate tumors are often successfully treated through standard techniques (e.g., radical prostatectomy, radiation, anti-androgen therapy). However, advanced stage and metastatic prostate cancer generally have poorer treatment prognoses, emphasizing a critical need to develop new techniques to improve patient outcomes. Prostatespecific membrane antigen (PSMA), also known as glutamate carboxypeptidase II (GCPII), is a classic type-II membrane glycoprotein and possesses ideal characteristics as an enzyme-biomarker target due to its unique expression in primary and metastatic prostate cancer cells3–6 and its proclivity to internalize upon binding targeting ligands.7–9 Of the chemical scaffolds used for targeting PSMA in prostate cancer research,10–15 our group developed phosphoramidate peptidomimetic inhibitors of PSMA to deliver an array of imaging8,16–20 and therapeutic21–23 agents to prostate cancer cells in vitro and in vivo. Of these, the CTT54 inhibitor core is particularly efficacious as a PSMA targeting molecule due to its high affinity (14 nM), pseudo-irreversible mode of binding,8,18 rapid uptake, and internalization in PSMA-positive (PSMA+) prostate cancer cells.
Nanoparticles represent an emerging technology in medicinal applications due to their unique pharmacokinetic properties, amenability for multi-functionalization, and high loading capacities. Because of these features, nanoparticles are attractive platforms for the development of multimodal theranostic agents.25,26 Gold nanoparticles (AuNPs) in particular possess distinct and controllable physicochemical properties which offer advantages over other nanoparticle platforms. The gold core is biocompatible and has been directly utilized in imaging (e.g., optical contrast27 and computed tomography28) and therapeutic (e.g., radiotherapy,29 photothermal ablation,30,31 mechanical disruption32) applications. Additionally, the gold surface can be modified by soft donors (e.g., thiols) tethered to reporting, therapeutic, targeting, or biological stabilizing molecules to generate multifunctional devices for in vitro and in vivo use.
چکیده
مراجع و یادداشت ها
Abstract
References and notes
