
دانلود رایگان مقاله اسپکتروسکوپی رامان افزایش سطح در الکتروفورز ریز تراشه
چکیده
اتصال الکتروفورز مویرگی ریز تراشه با اسپکتروسکوپی رامان افزایش سطح (MCE-SERS) موجب ترکیب قدرت بالای جداسازی الکتروفورز مویرگی با توانایی دستیابی به طیف لرزشی جهت شناسایی اجرا می گردد. طیف سنجی رامان یک روش تشخیص توصیفی است که به طور خاص برای آنالیز شیمیایی مناسب است چون غیر مخرب بوده و قابلیت شناسایی آنالیت ها را دارد. با این وجود نقطه ضعف آن حساسیت کم می باشد و حتی گاها به زمان های طولانی تری نسبت به پهنای پیک معمول جهت جداسازی های الکتروفورزی نیاز دارد. شدت رامان با نزدیک کردن آنالیت به سطح فلزات نانوساختار و یا کلوئیدها به شدت بهبود می یابد (علت اثر افزایش سطح). این مقاله رویکرد جدیدی در زمینه اتصال MCE-SERS بر خط ارائه می دهد. عنصر اصلی دستگاه میکروفلوئید شیشه ای پیشرفته یک ساختار دوزسنجی است که شامل دوکانال جانبی می شود. این دو کانال پس از جداسازی الکتروفورزی آنالیت ها به کانال MCE متصل می شود. کانال های دوزسنجی نانوذرات نقره (Ag-Nps) را به مناطق متفرقه الکتروفورزتیک ارائه می دهد. این مناطق ضبط از طیف SERS ترکیبات جداشده را آسان می کند. عملکرد تراشه MCE-SERS با آنالیز یک محلول مدل رودامین در 90 ثانیه با دستیابی به RSD زمان مهاجرت زیر 1.5% ارزیابی گردید. این رویکرد به طور موفقیت آمیزی برای تجزیه و تحلیل ریبوخلاوین افزودنی خوراکی در سس باربیکیو به کاربرده شد.
1. مقدمه
اسپکتروسکوپی رامان یک ابزار و تحلیل ارزشمند برای تشخیص شیمیایی ترکیبات بر اساس مشاهده تغییرات لرزشی ملکول پس از پراکندگی یر الاستیک فوتون های متقابل می باشد. با این وجود از آن جاییکه پراکندگی غیر الاستیک یک پدیده نادراست (به طور تخمینی 1 فوتون از 106 فوتون، سیگنال های رامان را فراهم می کند). اسپکتروسکوپی رامان دارای نقطه ضعف کمبود سیگنال است در اواخر دهه 1970 کشف شد که جذب آنالیت ها به نانوساختارهای فلزات نجیب منجر به بهبود چشمگیر حسایت با افزایش فاکتور تا 106-109 می شود. حتی حساسیت در حد یک ملکول نیز گزارش شده است [1,2]. این تکنینک که اسپکتروسکوپی رامان افزایش سطح (SERS) نامیده می شود اهمیت زیادی در شیمی تحلیلی مدرن دارد و همچنین در میکروفلوئیدها به کار می رود[3-10].
اثر SERS به طور گسترده حاصل ایجاد میدان مناطیسی در سطح نانوساختار فلزی پس از برهم کنش با فوتونهای دارای انرژی می باشد. واژه Hotspot (نقطه اشتراک) به فاصله بین دو (یا چند) نانوساختار اطلاق می شود که در آن نقطه میدان الکترومناطیس شدت می یابد و موجب ارتقا فاکتورهای افزایش می گردد.[8] در مورد نانوساختارهای فلزی که در منطقه تشخیص مستحکم شده اند، نقاط اشتراک با ایجاد ساختارهای دقیق (اغلب به صورت سلسه مراتبی) به دست می آید. [9]. روش های مبتنی بر نانو ذرات در محلول (NPS) پایه تجمع کنترل شده، معمولا افزایش قدرت یونی- به ویژه با افزودن کلریدها (مثلNaCl یا KCl) انجام می گیرد.
علیرغم این که گاه جداسازی ترکیبی در خط به طور فزاینده ای محدوده کاربردی های بالقوه را افزایش می دهد، ترکیب تکنولوژی های جداسازی با تشخیص SERS به ندرت مورد استفاده قرار می گیرد [4,11]. چالش هایی که از استفاده SERS به عنوان ابزار تحلیل در خط علم جداسازی جلوگیری می کند عبارت است از اغدام سوبسترا SERS مناسب و ضرورت به دست آوردن سری اطلاعات به ویژه برای نظارت همزمان در جداسازی سریع مانند HPLC یا الکتروفورز مویرگی (CE) می باشد. محدودیت های زمان ضبط طیف موجب محدود شدن حساسیت قابل دسترسی می گردد.
در یکی از اولین کارها در مورد اتصال CE-SERS، زمان انباشت با استفاده از یک میدان الکتریکی نسبتا ضعیف (16v/cm) تا 1 ثانیه بسط داده شد[12]. اما این عمل موجب افزایش زمان جداسازی و پیک های وسیع گردید. تشخیص آنلاین SERS به راحتی با افزودن محلول کلوئیدی نقره به الکترلیت پس زمینه (BGE) امکان پذیر شد. با این وجود شکل پیک را تحت تاثیر قرارداد و رسوب نانوذرات نقره (NPS) در پنجره تشخیص مشکلاتی را برای آنالیزهای بعدی ایجاد کرد. برای ترکیب HPLC با آنالیز SERS , Zaffino و همکاران از یک استراتژی افزودن ستون برای دوزسنجی یک محلول NPS برای خروجی استفاده کردند[13]. یک کویل پیچیده قبل از پنجره تشخیص SERS قرارداده شد که به عنوان میکسری برای NPS و آنالیت ها عمل می کرد. با وجود اینکه اختلاط برای جهت سیگنال SERS سودمند بود اما در دقت جداسازی اختلال ایجاد نمود.
ایجاد نقاط نقره در داخل کانال جداسازی از NPS [14] و پایش سازهای NPS [15] توسط ته نشت با استفاده از لیزر به عنوان یک روش جایگزین برای CE-SERS مورد آزمایش قرار گرفت و ضعف نانوساختارهای مستحکم شده را نمایان کرد. از آن جاییکه آنالیت ها با نقره ای ایجاد شده واکنش می دادند قله های تیزی مشاهده گردید. توسط گروه شولتز، که یک طراحی بر اساس نقل مکان سوبستری نقره به بعد از جداسازی مویرگی پیشنهاد شد و پیشرفت های چشمگیری را حاصل نمود[16]. مایع اضافی در امتداد خروجی مویرگی پمپاژ شد و آنالیت های جداشده را در سوبسترا جمع نمود همچنین موجب رطوبت آن گردید. در این زمینه، آنالیز نمونه های بیولوژیکی را با CE-SERS [17,18] کارپیش گام در زمینه LC-SERS مویرگی، گزارش کردند [19].
میکروفلوئیدهای بر پایه ریز تراشه یکپارچگی سیستم را تسهیل می کند و پتانسیل بالایی را برای ترکیب جداسازی فاز مایع و تشخیص رامان یا SERS در یک دستگاه ایجاد می کند. connaster و همکاران مفهومی برای انتقال درون خطی الکتروفورز مویرگی میکرو مکوئیدی(MCE) و SERS معرفی کردند [20]. جداسازی در یک پلت فرم میکروفلوئیدی PDMS شامل یک منطقه از خوشه های سه بعدی نقره انجام شد. پس از جداسازی الکتروفورزی، ولتاژ محرک جداسازی متوفق شد و قسمت نقره ای با استفاده از لیزر اسکن شده اگر چه این روش بسیار نوآورانه است و امکنا زمان تجمع نامحدود را فراهم می کند اما اسکن زمان زیاد و ابزار دقیق لازم دارد.
یکی از چالش های پیش رو در اهداف SERS جذب غیر قابل برگشت آنالیت ها است که مانع اندازه گیری های SERS در جریان پیوسته می گردد. یک راه حل برای این مشکل می تواند رویکرد تازه منتشر شده برای باز سازی الکتریکی سوبستراهای SERS روی تراشه باشد[21].
تشخیص رامان در HPLC ریزتراشه اخیرا توسط Geissler و همکاران با استفاده از پراکندگی منسجم ضد استوکس رامان گزارش شده است [23] افزودن یک محلول کلوئیدی نقره به عنوان سوبسترای SERS، پس از استون، نیز همان طور که توسط فیلور و همکاران ارائه شده، در تراشه HPLC انجام شده است. آن دستگاهی با یک ستون توسعه دادند و اختلاط پس از استون، افزودن نانوذرات برای تشخیص آنلاین SERS از طریق یک کانال جانبی کنترل می کرد [22]. یک چالش در این زمینه،مقابله با فشارهای مختلف برگشتی ستون جداسازی و کانال های جانبی بود. در جداسازی های الکترواسموزی همانند الکتروفوررز ریز تراشه مسایل مربوط به فشار معکوس نگرانی ندارد.
Abstract
Coupling microchip capillary electrophoresis to surface enhanced Raman spectroscopy (MCE-SERS) combines the high separation power of capillary electrophoresis with the capability to obtain vibrational fingerprint spectra for compound identification. Raman spectroscopy is a structurally descriptive and label-free detection method which is particularly suited for chemical analysis because it is nondestructive and allows the identification of analytes. However, it suffers from poor sensitivity and sometimes even requires acquisition times far longer than the typical peak width of electrophoretic separations. The Raman intensity can be drastically improved if the analyte is brought into close proximity to nanostructured metal surfaces or colloids due to the surface enhancement effect. This paper presents a novel approach in the field of MCE-SERS on-line coupling. The key element of the developed glass microfluidic device is a dosing structure which consists of two side channels joining the MCE channel symmetrically after the electrophoretic separation of the analytes. The dosing channel supplies silver nanoparticles (Ag-NPs), to the separated electrophoretic zones which facilitates an on-the-fly recording of SERS-spectra of the separated compounds. The functionality of the MCE-SERS chip was evaluated by the analysis of a rhodamine model mixture within 90 s achieving RSD of migration times below 1.5%. The approach was successfully applied for the analysis of the food additive riboflavin in a barbecue sauce.
1. Introduction
Raman spectroscopy is a valuable analytical tool for the chemical identification of compounds, based on monitoring vibrational changes in a molecule after inelastic scattering of interacting photons. However, since inelastic scattering is a rare phenomenon (it is estimated that only 1 photon from 106 provides Raman signals), Raman spectroscopy suffers from low signal intensity. In the late 1970, it was discovered, that the adsorption of analytes to noble metal nanostructures leads to a significant improvement in sensitivity with enhancementfactors of up to 106–109. Even sensitivities down to the single molecule level have been reported [1,2]. This technique, calledsurface enhancedRamanspectroscopy (SERS),has gained increased importance in modern analytical chemistry and has also been applied in microfluidics [3–10].
The SERS effect is to a large extend the result of the electromagnetic field occurring at the surface of metal nanostructure after the interaction with photons of suitable energy. The term hot-spot is used for a space in between two (or more) nanostructures, where this electromagnetic field becomes particularly intense leading to higher enhancement factors [8]. In the case of metal nanostructures, firmly embedded in the detection area, hot-spots are achieved by creation of precise (often hierarchical) structures [9]. Approaches based on in-solution nanoparticles (NPs) rely on controlledaggregation,usually initiatedby anincrease ofionic strength – typically via addition of chlorides (e.g. NaCl or KCl) [8,10].
Despite the fact that an on-line coupled separation step would dramatically increase the sphere of potential applications,the combination of separations technologies with SERS detection has only rarely been applied [4,11]. Challenges preventing SERS as an online analysis tool in separation science is the integration of suitable SERS-substrates and the necessity for rapid data acquisition, especially for real-time monitoring of fast separations like HPLC or capillary electrophoresis (CE). The limited spectra recording time severely restricts the achievable sensitivity.
In one of the first works aiming for CE-SERS coupling the accumulation time was extended up to 1 s by employing a rather low electrical field strength (16V/cm) [12]. However, this resulted in relative long separation times and broad peaks. Online SERSdetection was facilitated straightforwardly by the addition of a silver colloidal solution to the background electrolyte (BGE). This however affected the peak shape and the deposition of silver nanoparticles (NPs) in the detection window posed difficulties for subsequent analyses. For the combination of HPLC with SERSanalysis Zaffino et al. used a post column addition strategy to dose a NPs solution to the effluent [13]. A knitted coil located before the SERS detection window acted as a mixer for NPs and analytes. While mixing was beneficial for the intensity of the SERS signal, it impaired the separation resolution.
The creation of silver spots inside the separation channel from NPs [14] or NPs precursors [15] by laser-induced photo deposition was tested as an alternative approach for CE-SERS and revealed a weakness of firmly embedded nanostructures. Since analytes closely interacted with the created silver spot, severe peak tailing was observed. Significant improvements were achieved by the Schultz group, who proposed a design based on the placement of the silver substrate directly after the separation capillary [16]. Additional liquid was pumped along the capillary outlet focusing separated analytes onto the substrate and providing its refreshment at the same time. In this context, they reported the analysis of biological samples by CE-SERS [17,18] as well as a pioneering work in the field of capillary LC-SERS [19].
Chip based microfluidics facilitates system integration, and shows high potential to combine liquid phase separation and Raman or SERS detection on a single device. Connaster et al. introduced a concept for at-line coupling of microfluidic capillary electrophoresis (MCE) to SERS [20]. The separation was performed in a microfluidic PDMS platform involving a region of three-dimensional clusters of silver. After electrophoretic separation, the voltage driving the separation was stopped and a laser scanned over the silver section. Although this approach is very innovative and allows practically unlimited accumulation time,the scanning is time-consuming and requires sophisticated instrumentation. A challenge with stationary SERS targets is the common irreversible analyte adsorption which prevents consecutive SERS measurements with one target in continuous flow. A solution to that problem could be a recently published approach for electrically assisted regeneration of on-chip SERS substrates [21].
In chip-HPLC, Raman detection was only recently reported by Geissler et al. utilising coherent anti-Stokes Raman scattering [23]. The post column addition of a colloidal silver solution as SERSsubstrate has also been realised in chip-HPLC as shown by Taylor et al. They developed a device with a pillar-based column and a post-column diffusion controlled addition of NPs via a side channel for on-line SERS detection [22]. A challenge, in this context, was to deal with the different backpressure of the separation column and the side channel. In electroosmotically driven separations, such as in microchip electrophoresis, such backpressure issues as reported above are of no concern.
چکیده
1. مقدمه
2. مواد و روش ها
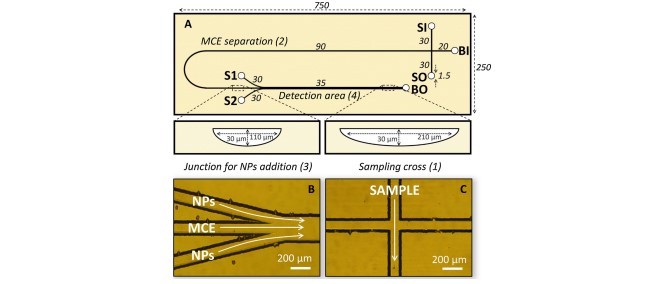
2.1 ساخت دستگاه میکروفلوئید
2.2 تشخیص MCE با فلوئور سانس و SERS
2.3 نانو ذرات نقره
2.4 مواد
3. بحث و نتیجه گیری
3.1 موقعیت یابی پنجره تشخیص
3.2 آزمایشات MCE-SERS
3.3. آنالیز MCE-SERS ریبوفلاوین
4. نتایج
منابع
ABSTRACT
1. Introduction
2. Materials and methods
2.1. Microfluidic device fabrication
2.2. MCE with fluorescence and SERS detection
2.3. Silver nanoparticles
2.4. Chemicals
3. Results and discussion
3.1. Positioning of detection window
3.2. MCE-SERS experiments
3.3. MCE-SERS analysis of riboflavin
4. Concluding remarks
References
