
دانلود رایگان مقاله مکانیزم های عصبی زمینه ساز قطع مصرف مورفین در بیماران معتاد
چکیده
مورفین یکی از قوی ترین آلکالوئیدها (شبه قلیاها) در تریاک است که دارای استفاده ها و الزامات پزشکی قابل توجه است و اولین اصل (ماده) فعال خالص شده از منبع گیاهی است. مورفین معمولاً برای تسکین درد متوسط تا شدید استفاده می شود زیرا به طور مستقیم بر روی سیستم عصبی مرکزی عمل می کند؛ با این وجود، سوء استفاده مزمن از آن تحمل و وابستگی جسمی را افزایش می دهد، که معمولاً به عنوان اعتیاد به مواد مخدر شناخته می شود. سندروم قطع مصرف مرفین, علائم فیزیولوژیکی و رفتاری است که از مواجهه طولانی با مرفین ناشی می شود. اکثر نواحی مغز, در پرهیز طولانی مدت و قطع مصرف حاد مورفین, کم کار می شوند. علاوه بر این، چندین مکانیسم عصبی به احتمال زیاد به قطع مصرف مورفین کمک می نمایند. بررسی حاضر, نوشته های مربوط به مکانیزم های عصبی اساسی قطع مصرف مورفین را خلاصه می کند. با وجود این واقعیت که قطع مصرف مرفین، یک فرایند پیچیده است، نشان داده شده است که مکانیسم های عصبی, نقش کلیدی در قطع مصرف مورفین دارند.
مقدمه
مورفین, اولین اصل (ماده) فعال خالص شده از منبع گیاهی (1،2) است. بررسی های رابطه فعالیت - ساختار آن, موجب کشف 200 مشتقات مورفین (به عنوان مثال، کدئین و داروهای مرتبط) و سنتز داروهای آنتاگونیست مشتق شده از مورفین شده است (به عنوان مثال، نالوکسان، نالترکسون و نالورفین) کشف کرده است (3). مرفین یک محصول طبیعی است، اما دارای پتانسیل بالا برای اعتیاد، تحمل، و وابستگی فیزیولوژیکی است. فرض می شود که وابستگی فیزیولوژیکی در چند ماه (4) توسعه می یابد. گیرنده های مورفین, گیرنده های مخدر هستند و با توجه به انتخاب خود در سنجش های اتصال و داروشناسی رده بندی می شوند (5) مانند گیرنده های- مو (6) و گیرنده های-دلتا (7). علاوه بر این، از میان تمام طبقات گیرنده های مواد مخدر، انواع کاپا, پیچیده ترین هستند (8).
مورفین به طور سنتی برای درمان درد شدید و مزمن (9)، به عنوان مثال تخلف انفارکتوس ميوکارد (MI) درد (10) مورد استفاده قرار گرفته است. همچنین فعالیت تنفسی و تنفس نامنظم را از بین می برد؛ با این حال، علت اصلی مرگ در مسمومیت مورفین, رکود تنفسی (3) است. به عنوان یک نتیجه از اتساع عروق محیطی، مقاومت محیطی ممکن است کاهش یابد. علاوه بر این، مورفین, ترشح روده را کاهش می دهد و جذب مایع روده را افزایش می دهد که یبوست (3) را به همراه می آورد. دوزهای بالای مورفین موجب مختل شدن ضربه زدن انگشت و توانایی حفظ یک سطح ثابت پایین از نیروی ایزومتریک (کنترل مختل شده موتور (محرک)) (11،12) می شود. همچنین نشان داده شد که مورفین نقش بسیار مهمی در یادگیری و حافظه (13) بازی می کند. یادگیری احترازی غیرفعال که به طور معمول توسط شاتل باکس (14) ارزیابی می شود، توسط مورفین (15) تحت تاثیر قرار می گیرد. سندروم قطع مصرف مورفین, از پاسخ سازگاری هادر سطوح مختلف با مکانیزم های مختلف ناشی می شود. اگر چه چندان شناخته شده نیست، تا کنون نشان داده شده است که چندین مکانیسم عصبی در قطع مصرف مورفین نقش دارند. این مقاله، به بررسی یافته ها در مورد پدیده ترک (قطع مصرف) و مکانیزم های موثر بر آن. می پردازد.
بازنگری نوشته ها
1. وابستگی و تحمل (یا حدود تحمل) مورفین
وابستگی به مجموعه ای از تغییرات در هموستاز یک ارگانیسم اشاره می کند, اگر دارو متوقف شود. چندین فرضیه, مکانیسم های سهیم در توسعه تحمل مرفین (16) را توضیح داده اند به عنوان مثال، محاصره عمل گلوتامات، فسفوریلاسیون و تغییرات ساختار (انطباقی) گیرنده (17)، جداسازی گیرنده ها از G-پروتئین ها و حساسیت زدایی گیرنده (18،19) درونی سازی گیرنده μ-مخدر و / یا تنظیم ضعیف گیرنده و تنظیم بالای مسیر cAMP (20). علاوه بر این، کوله سیستوکینین (CCK) واسطه برخی مسیرهای ضد نظارتی در تحمل به مواد مخدر است. مشخص شده است که داروهای CCK-آنتاگونیست، مانند پروگلومید، موجب توسعه تحمل به مرفین (21) می شوند.
2. قطع مصرف مورفین
با وجود استفاده از مواد مخدر به صورت تفریحی (22), آنها در میان مفیدترین داروها قرار دارند. سوء استفاده مزمن از این مواد مخدر منجر به تحمل و وابستگی فیزیکی به نام اعتیاد به مواد مخدر می شود. پس از مواجهه طولانی با مرفین (23), سندروم ترک (قطع مصرف) به صورت علائم فیزیولوژیکی و رفتاری نیز مشخص می شود. نشان داده شد که تماس طولانی با مواد مخدر موجب مختل شدن عملکرد عصبی (24) می شود. کمبود شناختی نیز حتی پس از فروکش کردن علائم جسمی قطع ناشی از اختلال در عملکرد مغز به واسطه سوء استفاده مزمن (25) حاضر است. قطع ناگهانی استفاده از مورفین به سندرم ترک اولیه منجر می شود که به خودی خود منجر مرگ آور نیست, اگر چه خودکشی، حملات قلبی، سکته مغزی، تشنج های ناشی از صرع و تأثیرات کم آبی شدید ممکن است منجر به فوت شوند.
علائم قطع مصرف با توجه به اعتیاد به مرفین معمولاً در مدت زمان کوتاهی قبل از زمان دوز بعدی برنامه ریزی شده، گاهی اوقات در عرض چند ساعت (به طور معمول بین 6-12 ساعت) پس از آخرین مصرف دیده می شوند. در این راستا، افسردگی شدید و استفراغ بسیار رایج است. فشار خون سیستولیک و دیاستولیک و ضربان قلب در طول دوره قطع مصرف افزایش می یابد. و همچنین اسپاسم های عضلانی، درد شدید در استخوان ها و عضلات پشت و اندام ها ظاهر می شود. یک مخدر مناسب را می توان برای معکوس نمودن علائم ترک در هر نقطه در طول این فرایند اعمال نمود. علائم ترک عمده, 48 تا 96 ساعت پس از آخرین دوز به اوج می رسند و پس از 8 تا 12 ساعت (26) فروکش می کنند.
2.1. قطع مصرف مرفین و عملکرد مغز
بسیاری از مناطق مغز, کاهش عملکرد در پرهیز طولانی مدت و قطع مصرف حاد مورفین را نشان می دهند. نقصان حافظه پس از قطع مصرف مرفین به عود مواد مخدر (21،27) منجر می شود. فعالیت های قشر و حاشیه ای در قطع مصرف سرکوب می شوند که ممکن است به اختلال حافظه (25) مربوط شود. نشان داده شد که هیپوکامپوس نقش مهمی در پردازش حافظه ایفا می کند و تراکم بالایی از گیرنده های گلوکوکورتیکوئید در این منطقه از مغز (28) وجود دارد. بررسی های اخیر, سهم کورتیکوسترون و آنتاگونیست گیرنده آن را در پیشگیری از نقصان حافظه ناشی از قطع مصرف مورفین برجسته کرده اند. غلظت بالایی از کورتیکوسترون در قطع مصرف, موجب مختل شدن وظیفه شناسایی شی می شود که توسط متیرافون و میفرپیستون (29،30) معکوس می شود. جالب توجه است که یک تعامل عملکردی بین گیرنده مخدرها و گیرنده های غده ای در تعدیل فرآیندهای مرکزی (31) حاضر است که می تواند به مدولاسیون حافظه (32) کمک کند. قطع مصرف مورفین موجب مختل شدن فروشناندن ترس می شود که ممکن است به علت کمبود هیستامین مزمن باشد و سطح هیستامین مغز به کمبود شناختی بعد از قطع مصرف مرفین (33) کمک می کند. نشان داده شد که غلظت بالای کورتیزول مغز موجب آسیب عصبی و از دست دادن حافظه (34) می شود. کورتیزول, اختلال در حافظه غیر مستقیم را از طریق اسیدهای آمینه محرک به جای تاثیر مستقیم (35), به همراه می آورد. بنابراین، رشد غلظت کورتیکوسترون در مغز می تواند اختلال شناختی بعد از قطع مصرف مرفین (36) را توضیح دهد. علاوه بر این، شدت علائم ترک مرفین با مقدار رشد وابستگی جسمی مرتبط است. در نتیجه سطح افزایش غلظت کورتیکوسترون سرم ناشی از نالوکسان با سطح توسعه وابستگی جسمی (36) در ارتباط است. پرهیز از مورفین می تواند سلول های A2 را فعال نماید، یعنی، محور عصبی آدرنرژیک در هسته دستگاه انفرادی، که پس از آن باعث تحریک گیرنده های آدرنرژیک در هسته پارا-شکمی به منظور آزادسازی هورمون آزادکننده – کورتیکوتروپین (CRH) می شود. CRH نیز در غده هیپوفیز در راه انتقال استخوان بازو برای آزادسازی هورمون آدرنوکورتیکوتروفیک (ACTH) عمل می کند که به نوبه خود موجب آزادسازی کورتیکواستروئید از قشر آدرنال (37) می شود. این مورد, یافته هایی را تأیید می کند که نشان می دهند عوامل مسدودکننده آدرنرژیک مانع ترشح ACTH ناشی از قطع مصرف مرفین (37) می شوند.
2.2. اثر کلسیم بر ترک مورفین
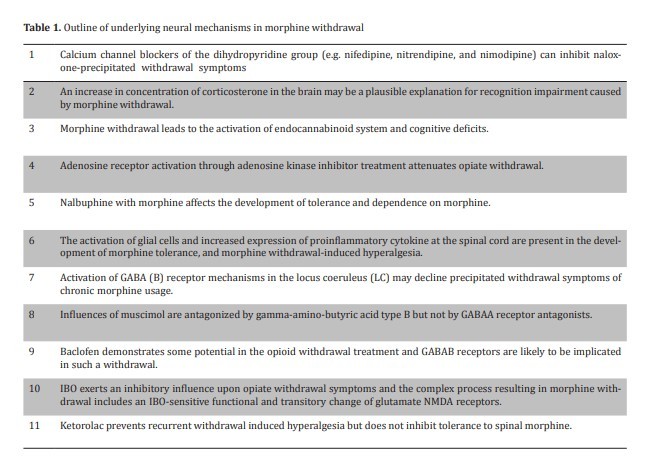
مسدود کننده های کانال کلسیم گروه دی هیدروپیریدینی مانند وراپامیل (38)، نیفدیپین، نیترندیپین و نیمودیپین (39) می توانند علائم ترک نالوکسون- ته نشین شده را مهار کند. اثرات نیمودیپین، آنتاگونیست کانال کلسیم نوع L روی افت حافظه ناشی از ترک مورفین خود به خودی در موش (40) مطالعه شده است. با این حال، نشان داده شد که نیفدیپین مانع علائم ترک نالوکسون- تثبیت شده می شود، که از نظر آماری معنی دار نبود، و این تفاوت ممکن است با توجه به روش شناسی متفاوت باشد. مطالعه دیگری در موش ها که در آن نالوکسان برای ترک استفاده نشد، نشانه های مختلف ترک را نشان داد، شامل نوشتن، فش فش، اسهال، دندان قروچه، پتوز پلک، و لرزش نوع مرطوب 18 ساعته پس از پایان مصرف مرفین (41). نشان داده شد که هر دو مکانیزم های مرکزی و محیطی, نقش های مهمی در مهار سندرم قطع مرفین با استفاده از مسدود کننده های کانال کلسیم ایفا می نمایند؛ چنین تأثیراتی از عمل مستقل از گیرنده های مواد مخدر (41) ناشی می شود. علاوه بر این، محاصره کانال های کلسیم وابسته به ولتاژ نوع-: با استفاده از مسدود کننده های کانال کلسیم موجب تضعیف سندرم قطع مرفین می شود. کانال های کلسیم وابسته به ولتاژ نوع-T, نقش حیاتی در توسعه وابستگی به مرفین و ترک (42) ایفا می کند.
Abstract
Morphine is one of the most potent alkaloid in opium, which has substantial medical uses and needs and it is the first active principle purified from herbal source. Morphine has commonly been used for relief of moderate to severe pain as it acts directly on the central nervous system; nonetheless, its chronic abuse increases tolerance and physical dependence, which is commonly known as opiate addiction. Morphine withdrawal syndrome is physiological and behavioral symptoms that stem from prolonged exposure to morphine. A majority of brain regions are hypofunctional over prolonged abstinence and acute morphine withdrawal. Furthermore, several neural mechanisms are likely to contribute to morphine withdrawal. The present review summarizes the literature pertaining to neural mechanisms underlying morphine withdrawal. Despite the fact that morphine withdrawal is a complex process, it is suggested that neural mechanisms play key roles in morphine withdrawal.
Introduction
Morphine is the first active principle purified from herbal source (1,2). Investigation on its structureactivity relationship has discovered 200 morphine derivatives (e.g., codeine and related drugs) and synthesis of morphine-derived antagonist drugs (e.g., naloxone, naltrexone and nalorphine) (3). Morphine is a natural product but has high potential for addiction, tolerance, and psychological dependence. It is postulated that physiological dependence develops in several months (4). Morphine receptors are opioid receptors and categorized according to their selectivity in binding and pharmacological assays (5) such as mu-receptors (6) and delta-receptors (7). In addition, of all the classes of opioid receptors, the kappa types are the most complex (8).
Morphine has been traditionally utilized to treat severe and chronic pain (9), for instance myocardial-infraction (MI) pain (10). It suppresses the respiratory activity, and irregular breathing; even so, the main cause of death in morphine poisoning is respiratory depression (3). As a consequence of peripheral vasodilatation, peripheral resistance may decrease. Additionally, morphine declines intestinal secretion and increases intestinal fluid absorption, which inbrings about the constipation (3). High doses of morphine impair finger tapping and the ability of maintaining a low constant level of isometric force (impaired motor control) (11,12). It was also demonstrated that morphine plays a crucial role in learning and memory (13). Passive avoidance learning, which is normally assessed by shuttle box (14), is affected by Morphine (15). Morphine withdrawal syndrome results from adaptations’ response on multiple levels with different mechanism. Although little is known, several neural mechanisms have thus far been shown to be involved in morphine withdrawal. This paper reviews the findings regarding the withdrawal phenomenon and its contributory mechanisms.
Literature review
1. Morphine dependence and tolerance
Dependence refers to a set of changes in the homeostasis of an organism if the drug is stopped. Several hypotheses have explained the contributory mechanisms of development of morphine tolerance (16) for example, blockade of glutamate action, phosphorylation and the receptor conformation changes (17), decoupling of receptors from G-proteins and the receptor desensitization (18,19), μ-opioid receptor internalization and/or receptor down-regulation and up-regulation of the cAMP pathway (20). Moreover, cholecystokinin (CCK) mediates some counter-regulatory pathways in opioid tolerance. CCK-antagonist medicines, such as proglumide, have been found to develop the tolerance of morphine (21).
2. Morphine Withdrawal
Opiates are amongst the most useful medications, despite their usage as recreational drugs (22). Chronic misuse of such drugs leads to tolerance and physical dependence called as opiate addiction. Withdrawal syndrome is also found as physiological and behavioral symptoms subsequent to prolonged exposure to morphine (23). Prolonged exposure to opiates was demonstrated to disrupt neural function (24). Cognitive deficit is also present even following subsiding somatic withdrawal signs resulting from impairment of brain function by chronic misuse (25). Abrupt cessation of morphine usage results in the prototypical withdrawal syndrome, which is not fatal by itself, although suicide, heart attacks, strokes, seizures proceeding to status epilepticus and influences of extreme dehydration may produce fatal outcomes.
The withdrawal symptoms owing to morphine addiction are typically seen shortly prior to the time of the next scheduled dose, sometimes within a few hours (normally between 6–12 hours) following the last administration. In this regard, severe depression and vomiting are very common. Systolic and diastolic blood pressure and heart rate increase over the acute withdrawal period. As well as to muscle spasms, severe pain in the bones and muscles of the back and extremities will be appeared. A suitable narcoticmay be administered to reverse the withdrawal symptoms at any points over this process. Major withdrawal symptoms peak 48 to 96 hours subsequent to the last dose and subside after 8 to 12 hours (26).
2.1. Morphine withdrawal and brain function
Most of brain regions show decreased function in prolonged abstinence and acute morphine withdrawal. Memory deficit following morphine withdrawal results in drug relapse (21,27). Cortical and limbic activities are suppressed in the withdrawal that may pertain to the memory impairment (25). It was shown that hippocampus plays an important role in memory processing and a high density of glucocorticoid receptors exists in this region of the brain (28). Recent investigations have highlighted the contribution of corticosterone and its receptor antagonist to prevention of morphine withdrawal memory deficit. High concentration of corticosterone in the withdrawal impairs object recognition task that is reversed by methyrapone and mifepristone (29,30). Interestingly, a functional interaction between opioids receptors and adenoreceptors is present in modulating central processes (31), which may contribute to the modulation of memory (32). Morphine withdrawal impairs fear extinction, which may be due to chronic histamine deficiency and the brain histamine level contributes to cognitive deficit subsequent to morphine withdrawal (33). High concentration of brain cortisol was shown to cause neuronal damage and memory loss (34). Cortisol brings about indirect memory impairment through stimulative amino acids rather than the direct impact (35). Therefore, corticosterone concentration growth in the brain may explain recognition impairment subsequent to morphine withdrawal (36). Furthermore, the intensity of morphine withdrawal symptoms is associated with the extent of development of physical dependence. The level of increase of naloxone-induced serum corticosterone concentration is thus associated with the level of development of physical dependence (36). Morphine abstinence can activate A2 cells, that is, adrenergic nerve axis in nuclei of solitary tract, which thereafter stimulates adrenergic receptors in paraventricular nucleus in order to liberate corticotropinreleasing hormone (CRH). CRH also acts at the pituitary gland in the way of humeral transmission for liberation of adrenocorticotrophic hormone (ACTH) that, in turn, liberates corticosteroid from the adrenal cortex (37). This corroborates the findings that indicate adrenergic blocking agents inhibit ACTH secretion arising from morphine withdrawal (37).
2.2. The effect of calcium on morphine withdrawal
Calcium channel blockers of the dihydropyridine group such as verapamil (38), nifedipine, nitrendipine, and nimodipine (39) can inhibit naloxoneprecipitated withdrawal symptoms. Effects of the nimodipine, L-type calcium channel antagonist has been studied on memory loss caused by spontaneous morphine withdrawal in mice (40). However, it was showen that nifedipine inhibited the signs of naloxone-precipitated withdrawal, which was not statistically significant, and the difference might be owing to different methodology applied. Another study in rats in which naloxone was not used for withdrawal, showed various withdrawal symptoms, involving writhing, squealing, diarrhea, teeth chattering, eyelid ptosis, and wet -type shaking 18 hours following the end of morphine administration (41). Both central and peripheral mechanisms were demonstrated to serve important roles in the inhibition of morphine abstinence syndrome using calcium channel blockers; such impacts result from an action independent of opioid receptors (41). In addition, blockade of Ltype voltage-dependent calcium channels by means of calcium channel blockers attenuates morphine withdrawal syndrome. T-type voltage dependent calcium channels play a crucial role in the development of morphine dependence and withdrawal (42).
چکیده
مقدمه
بازنگری نوشته ها
1. وابستگی و تحمل (یا حدود تحمل) مورفین
2. قطع مصرف مورفین
2.1. قطع مصرف مرفین و عملکرد مغز
2.2. اثر کلسیم بر ترک مورفین
2.3. گلوکوکورتیکوئیدها و ترک مورفین
2.4. کانابینوئید و ترک مورفین
2.5. مهار کننده های آدنوزین کیناز و ترک مورفین
2.6. مصرف همزمان نالبوفین، (کاپا-آگونیست) و مورفین
2.7. تحمل مورفین، پردردی القاء شده از ترک، و پاسخ های ایمنی التهابی ستون فقرات مرتبط با پروپنتوفیلین
2.8. علائم قطع مرفین و یک آگونیست گیرنده GABAB در در هسته لوکوس سرولئوس موش ها
2.9. علائم قطع مرفین و موسیمول در هسته لوکوس سرولئوس موش ها
2.10. علائم قطع مرفین و باکلوفن آگونیست گیرنده GABA B
2.11. میرایی ایبوگاین در ترک مورفین در موش ها: نقش گیرنده های گلوتامات N-متیل-داسپارتات.
2.12. کتورولاک مانع پردردی ناشی از ترک مکرر می شود اما تحمل به مرفین نخاعی را مهار نمی کند
نتیجه گیری
منابع
ABSTRACT
Introduction
Literature review
1. Morphine dependence and tolerance
2. Morphine Withdrawal
2.1. Morphine withdrawal and brain function
2.2. The effect of calcium on morphine withdrawal
2.3. Glucocorticoids and morphine withdrawal
2.4. Cannabinoid and morphine withdrawal
2.5. Adenosine kinase inhibitors and morphine withdrawal
2.6. Co-administration of nalbuphine, (kappa-agonist) and morphine
2.7. Morphine tolerance, withdrawal-induced hyperalgesia, and associated spinal inflammatory immune responses by propentofylline
2.8. Morphine withdrawal signs and a GABAB receptor agonist in the locus coeruleus of rats
2.9. Morphine withdrawal signs and muscimol in the locus coeruleus of rats
2.10. Morphine withdrawal signs and the GABA B receptor agonist baclofen
2.11. Ibogaine attenuation of morphine withdrawal in mice: role of glutamate N-methyl-Daspartate receptors.
2.12. Ketorolac prevents recurrent withdrawal induced hyperalgesia but does not inhibit tolerance to spinal morphine
Conclusion
References
