
دانلود رایگان مقاله مقایسه کنترل شده یک نوع گیاه دارویی برای جلوگیری از بیماری کوه زدگی در میان مسافران
چکیده
هدف: ارزيابي اثربخشي جینگو بیلوبا، استازولاميد و تركيب آنها به عنوان طب پيشگيري در برابر بيماري کوه زدگی.
طراحی: آزمایش آینده نگرانه, دوسویه کور، تصادفی و کنترل شده دارونما.
محیط : معبر اردوگاه پایه کوه اورست در نپال هیمالیا در ارتفاع 4280 متر یا 4358 متر و نقطه پایانی مطالعه در 4928 متر در طی اکتبر و نوامبر سال 2002
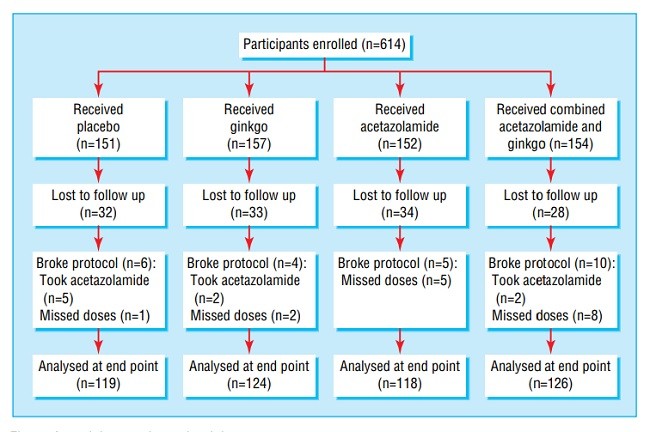
شرکت کنندگان : 614 گاری سوار سالم غربی (487 نفر آزمایش را تکمیل کردند) اختصاص یافته برای دریافت جینگو، استازولامید، ترکیب استازولامید و جینگو یا دارونما، ابتدائاً با در نظر گرفتن حداقل سه یا چهار دوز قبل از ادامه صعود.
معیارهای نتیجه اصلی : میزان بروز اندازه گیری شده توسط امتیاز بیماری کوه زدگی لیک لوئیس با سردرد و یکی دیگر از علائم. معیارهای نتیجه ثانویه شامل میزان اکسیژن خون، شدت سندرم ( امتیازات لیک لوئیس ≥ 5)، بروز سردرد و شدت سردرد بودند.
نتایج : برای هر نتیجه, جینگو, تفاوت معنی داری با دارونما نداشت. با این حال, شرکت کنندگان در گروه استازولامید, سطوح قابل توجهی از حفاظت را نشان دادند. شیوع بیماری کوه زدگی, 34٪ برای دارونما، 12٪ برای استازولامید (نسبت شانس 3.76، بازه اطمینان 95٪ 1.91 تا 7.39، تعداد مورد نیاز برای درمان 4)، 35٪ برای جینگو (0.95، 0.56 تا 1.62) و 14 ٪ برای ترکیب جینگو و استازولامید (3.04، 1.62 تا 5.69) بود. نسبت بیماران دارای افزایش شدت بیماری کوه زدگی, 18٪ برای دارونما، 3٪ برای استازولامید (6.46، 2.15 تا 19.40، تعداد مورد نیاز برای درمان 7)، 18٪ برای جینگو (1، 0.52 تا 1.90) و 7٪ برای ترکیب جینگو و استازولامید (2.95، 1.30 تا 6.70) بود.
نتیجه گیری ها : در مقایسه با دارونما، جینگو در جلوگیری از بیماری کوه زدگی موثر نیست. استازولامید 250 میلی گرم دوبار در روز، حفاظت قوی در برابر علائم بیماری کوه زدگی را فراهم نمود.
مقدمه
بیماری کوه زدگی, یک سندروم است که در ارتفاع بیش از 2000 متری به خاطر سازگاری فیزیولوژیک نادرست, پس از هایپوباریک هیپوکسیا (بیماری ارتفاع بالا) اتفاق می افتد. مشخصات این وضعیت که به سرعت قابل بازگشت می باشد, سردرد، سرگیجه، خستگی، حالت تهوع و بی خوابی است. در صورت عدم درمان، این وضعیت ممکن است به ورم مغزی در ارتفاع بالا یا ورم ریوی منجر شود که تهدیدکننده جان فرد می باشد.
گرچه جنبه های قابل تغییر در سفرهای ارتفاع بالا مانند سرعت صعود و اعمال فشار, واسطه های اصلی ایجادکننده خطر هستند، پیشگیری دارویی با استازولامید نیز با وجود عوارض جانبی رایج مانند احساس خارش یا سوزش روی پوست، نارسایی چشایی و ادرار زیاد که می تواند تطابق افراد با محیط را بکاهد, موثر است. بیماری کوه زدگی, یک تشخیص رایج در ارتفاع بالا است و عوامل دارویی موثر، به آسانی در دسترس و عوامل پیشگیری کننده ایمن مورد نیاز هستند.
جینگو بیلوبا یک مکمل گیاهی شناخته شده است که به عنوان یک عامل پیشگیری کننده جدید برای پیشگیری از بیماری کوه زدگی پدید آمده است. 3-8 شواهد غیرمستقیم نشان می دهد که این عامل می تواند از آسیب هیپوکسی (کمبود اکسیژن در بافت های بدن) جزئی که ناشی از فعالیت آنتی اکسیدانی آن است, جلوگیری نماید و در آزمایشات بالینی, مشخصات عوارض جانبی آن مشابه دارونما بود. 10 گروه ما نشان داده است که جینگوی پیشگیری کننده ممکن است منجر به خفیف شدن بیماری کوه زدگی و عوارض جانبی شناخته شده شود و این نشان می دهد که جینگو می تواند یک جایگزین مناسب برای استازولامید باشد. با این حال، نتایج چندین آزمایش تصادفی کنترل شده با جینگو, نتایجی ترکیبی بوده است.
تاکنون هیچ آزمایش مقیاس بزرگ، تصادفی, کنترل شده برای مقایسه جینگو با استازولامید در مورد پیشگیری از بیماری کوه زدگی یا آزمایش دو ترکیب برای ایمنی و اثربخشی افزودنی وجود نداشته است. ما این اثر را با جینگو، استازولامید یا ترکیب جینگو و استازولامید با دارونما در مورد بروز و شدت بیماری کوه زدگی و سردرد در افرادی که در ارتفاعات بالا سفر می کنند (با گاری)، مقایسه نمودیم.
روش ها
مطالعه ما به عنوان یک آزمایش آینده نگرانه, تصادفی، دوسویه کور، کنترل شده با دارونما انجام شد. ثبت نام بین 6 اکتبر و 24 نوامبر 2002 در امتداد معبر کوه اورست در نپال هیمالیا صورت گرفت.
معیار نتیجه اولیه از پیش تعیین شده، بروز و شدت بیماری کوه زدگی در نقطه انتهایی مطالعه بود که توسط سیستم امتیاز دهی لیک لوئیس مورد ارزیابی قرار گرفت که یک استاندارد اعتباردهی شده برای ارزیابی بیماری کوه زدگی در این زمینه بود. 11-13. تعیین میزان بیماری کوه زدگی با استفاده از پرسشنامه لیک لوئیس در یک محیط با ارتفاع بالا به عنوان یک نمره سه یا بیشتر با سردرد و حداقل یکی از علائم تهوع یا استفراغ، خستگی، سرگیجه و یا مشکل خواب صورت می گیرد. نقاط انتهایی از پیش تعیین شده ثانویه شامل بروز و شدت سردرد و اکسی متری (اندازه گیری میزان اکسیژن) پالس نقطه نهایی (Nonin Medical Products، Minneapolis، USA) بود. داده های شخصی، مشخصات صعود، انطباق و عوارض جانبی مورد تجزیه و تحلیل قرار گرفتند.
آزمایش ما دوسویه کور بود و کد تصادفی سازی توسط رایانه با استفاده از توسط Deurali-Janta Pharmaceuticals (کاتماندو، نپال) ساخته شد و توسط یک پزشک مستقل حفظ شد. عصاره استانداردسازی شده جینگو GK 501 توسطPharmaton (Lugano، سوئیس) اکیداً مطابق با استانداردهای کمیسیون اروپایی آلمان، با حداقل 24٪ گلیکوزیدهای جینگو فلاون و 6٪ ترپن ها ساخته شد. استازولامید توسط Wyeth ساخته شد (مدیسون، ایالات متحده آمریکا). نمونه هایی از دسته تصادفی داروهای مطالعه, به وسیله Boehringer-Ingelheim (آلمان) از نظر خلوص و فعالیت آنها مورد تایید قرار گرفتند.
تصادفی سازی و پیگیری
پس از اخذ رضایت نامه آگاهانه امضا شده, مسافران پرسشنامه ها را تکمیل کردند. معیارهای ورود به مطالعه, مردان و زنان سالم غیرنپالی در سن 18-65 سال مسافر مستقیم بین روستاهای ابتدای مطالعه Pheriche یا Dingboche (به ترتیب 4280 متر و 4358 متر) و نقطه پایانی در Lobuje (4928 متر) مشخص نمودند. در صورتی که شرکت کنندگان بالقوه مبتلا به بیماری کوه زدگی بودند، دارای علائم و نشانه های عفونت شدید حاد داشتند، در ارتفاع بیش از 4500 متری خوابیده بودند، جینگو یا استازولامید را در طی دو هفته قبل از ثبت نام مصرف کرده بودند، یا هرگونه بیماری قلبی، رحمی و سایر بیماری های مزمن داشتند که آنها را در معرض خطر بالقوه بالای بیماری قرار می داد, از مطالعه حذف می شدند.
مسافران تازه وارد به ارتفاع پایه به طور روزانه غربال شدند و به صورت سریالی با شماره تصادفی ثبت نام کردند. آنها پرسشنامه لیک لوئیس را تکمیل کردند، قرائت های اکسی متری پالس از آنها گرفته شد و داده هایی در خصوص مشخصات شخصی و سرعت صعود ارائه دادند. اطلاعاتی در مورد روش های کاهش ریسک بیماری کوه زدگی به آنها داده شد. شرکت کنندگان به صورت دوسویه کور تقسیم شدند تا دو بار در روز, جینگو 120 میلی گرم، استازولامید 250 میلی گرم، ترکیب جینگو 120 میلی گرم و استازولامید 250 میلی گرم یا دارونما دریافت نمایند. قبل از اقدام به سفر خود بدون هیچ گونه تأثیری از مدیران مطالعه، شرکت کنندگان حداقل سه یا چهار دوز داروهای مطالعه را در ارتفاع پایه مصرف نمودند. در هنگام صعود آنها از ارتفاع ابتدای مطالعه، برخی از شرکت کنندگان در طول شب در یک اقامتگاه در ارتفاع 4595 متری توقف نمودند، اما همه انتظار داشتند که به ارتفاع نقطه پایانی برای جمع آوری داده ها (پرسشنامه ی لیک لوئیس، اکسی متری پالس، سرعت صعود و عوارض جانبی) برسند. نمرات لیک لوئیس صبح روز بعد از ورود گرفته شد که پس از آن, مطالعه کامل شد.
Abstract
Objective To evaluate the efficacy of ginkgo biloba, acetazolamide, and their combination as prophylaxis against acute mountain sickness.
Design Prospective, double blind, randomised, placebo controlled trial.
Setting Approach to Mount Everest base camp in the Nepal Himalayas at 4280 m or 4358 m and study end point at 4928 m during October and November 2002.
Participants 614 healthy western trekkers (487 completed the trial) assigned to receive ginkgo, acetazolamide, combined acetazolamide and ginkgo, or placebo, initially taking at least three or four doses before continued ascent.
Main outcome measures Incidence measured by Lake Louise acute mountain sickness score ≥ 3 with headache and one other symptom. Secondary outcome measures included blood oxygen content, severity of syndrome (Lake Louise scores ≥ 5), incidence of headache, and severity of headache.
Results Ginkgo was not significantly different from placebo for any outcome; however participants in the acetazolamide group showed significant levels of protection. The incidence of acute mountain sickness was 34% for placebo, 12% for acetazolamide (odds ratio 3.76, 95% confidence interval 1.91 to 7.39, number needed to treat 4), 35% for ginkgo (0.95, 0.56 to 1.62), and 14% for combined ginkgo and acetazolamide (3.04, 1.62 to 5.69). The proportion of patients with increased severity of acute mountain sickness was 18% for placebo, 3% for acetazoalmide (6.46, 2.15 to 19.40, number needed to treat 7), 18% for ginkgo (1, 0.52 to 1.90), and 7% for combined ginkgo and acetazolamide (2.95, 1.30 to 6.70).
Conclusions When compared with placebo, ginkgo is not effective at preventing acute mountain sickness. Acetazolamide 250 mg twice daily afforded robust protection against symptoms of acute mountain sickness.
Introduction
Acute mountain sickness is a syndrome that occurs above 2000 m secondary to failed physiological adaptation to acute hypobaric hypoxia. This rapidly reversible condition is characterised by headache, lightheadedness, fatigue, nausea, and insomnia. If untreated the condition may progress to life threatening high altitude cerebral oedema or pulmonary oedema.
Although modifiable aspects of high altitude travel such as ascent rate and exertion are the primary mediators of risk, pharmaceutical prevention with acetazolamide is also effective despite common side effects such as parasthesias, dysgeusia, and diuresis, which may reduce compliance. Acute mountain sickness is a common diagnosis at high altitude, and effective, readily available, and safer prophylactic agents are needed.
Ginkgo biloba is a popular herbal supplement, which has emerged as a new prophylactic agent for the prevention of acute mountain sickness.3–8 Indirect evidence suggests that it may prevent hypoxic damage in tissues in part as a result of its antioxidant activity, and in clinical trials its side effects profile was similar to placebo.9 10 Our group has shown that prophylactic ginkgo may lead to a reduction in acute mountain sickness, with no recognisable side effects, indicating that it may be a viable alternative to acetazolamide.4 The results of multiple small randomised controlled trials with ginkgo have, however, been mixed.
To date there have been no large scale, randomised controlled trials comparing ginkgo with acetazolamide on prevention of acute mountain sickness or testing the two combined for safety and additive efficacy. We compared the effect either ginkgo, acetazolamide, or combined ginkgo and acetazolamide with placebo on the incidence and severity of acute mountain sickness and headache in people who trek at high altitudes.
Methods
Our study was designed as a prospective, randomised, double blind, placebo controlled trial. Enrolment took place between 6 October and 24 November 2002 along the Mount Everest approach in the Nepal Himalayas.
The predetermined primary outcome measure was incidence and severity of acute mountain sickness at the study end point as judged by the Lake Louise scoring system, a well validated standard for evaluation of acute mountain sickness in the field.11–13 Acute mountain sickness is quantified on the Lake Louise questionnaire in a high altitude setting as a score of three or greater, with headache and at least one of the symptoms of nausea or vomiting, fatigue, dizziness, or difficulty sleeping. Predetermined secondary end points included incidence and severity of headache and endpoint pulse oximetry (Nonin Medical Products, Minneapolis, USA). Personal data, ascent profile, compliance, and side effects were analysed to discount potential confounders.
Our trial was double blinded, and the randomisation code was computer generated by Deurali-Janta Pharmaceuticals (Kathmandu, Nepal) and held by an independent physician. The standardised ginkgo extract GK 501 was manufactured by Pharmaton (Lugano, Switzerland) in strict accordance with German European Commission standards, with no less than 24% ginkgoflavone glycosides and 6% terpenes. The acetazolamide was manufactured by Wyeth (Madison, USA). Samples from the randomised batch of study drugs were verified for purity and activity by Boehringer-Ingelheim (Germany).
Randomisation and follow up
Trekkers completed questionnaires after giving signed informed consent. Inclusion criteria specified healthy non-Nepali males and females aged 18-65 years travelling directly between the baseline villages of Pheriche or Dingboche (4280 m and 4358 m, respectively) and the end point in Lobuje (4928 m). Potential participants were excluded if they had acute mountain sickness, had signs and symptoms of a substantial acute infection, had slept above 4500 m, had taken ginkgo or acetazolamide within two weeks before enrolment, or had any known cardiac, pulmonary, or other chronic disease that would render them at increased risk of altitude illness.
Trekkers newly arrived at the baseline altitude were screened daily and serially enrolled by randomisation number. They completed the Lake Louise questionnaire, had pulse oximetry readings taken, and provided data on personal characteristics and rate of ascent. They were given information on methods for reducing the risk of acute mountain sickness. Participants were randomised in a double blind fashion to receive twice daily either ginkgo 120 mg, acetazolamide 250 mg, combined ginkgo 120 mg and acetazolamide 250 mg, or placebo. Participants took a minimum of three or four doses of the study drugs at baseline altitude before proceeding on their trek without any influence from study administrators. On their ascent from baseline, some participants stopped overnight at a lodge at 4595 m, but all were expected to arrive at the end point altitude for data collection (Lake Louise questionnaire, pulse oximetry, rate of ascent, and side effects). Lake Louise scores were taken the morning after arrival, after which the study was complete.
چکیده
مقدمه
روش ها
تصادفی سازی و پیگیری
محاسبه قدرت و تجزیه و تحلیل آماری
نتایج
بحث و بررسی
محدودیت های مطالعه
Abstract
Introduction
Methods
Randomisation and follow up
Power calculation and statistical analysis
Results
Discussion
Limitations of the study
