
دانلود رایگان مقاله تفکیک غشاء سلولی
خلاصه
بسیاری از فرایندهای مرتبط با غشاء سلولی نیازمند جدایی فضا-زمانی گذرای اجزاء در اندازه هایی در مقیاس مولکول های جفت شده تا میکرومتر هستند. درک این فرایندها نیازمند درک چگونگی خود-سازماندهی لیپیدها و پروتیین ها و میانکنش آنها با کورتکس سلول است. در اینجا ما پیشرفت های اخیر کالبدشکافی مکانیسم های تشکیل غشاء سلولی را مرور می کنیم. ما به چالش های موجود در مطالعه ی سازماندهی غشاء سلولی ،در ک فعلی از خود- سازماندهی غشاء سلولی برای تشکیل دومین های گذرا و نقش داربست پروتیینی در سازماندهی غشاء سلولی اشاره می کنیم. ما درباره ی دومین های پیام رسانی به عنوان یک نمونه ی مهم از تشکیل غشاء گذرا بحث می کنیم . ما با اشاره به محدودیت های موجود برای اندازه گیری سازماندهی غشاء در سلولهای زنده و قدم هایی که برای پیشرفت این رشته لازم هستند نتیجه گیری خواهیم کرد.
مقدمه: چالش های پیش روی مطالعه ی سازماندهی غشاء سلولی
درک سازماندهی غشاء پلاسمایی تقریبا به مدت نیم قرن یکی از اهداف اصلی زیست شناسی سلولی و بیوفیزیک بوده است. علی رغم شناسایی اکثر واحدهای ساختمانی اصلی (لیپیدها، پروتیین ها و قندها) و بیشتر اصول سازماندهی، ما درک کافی از چگونگی میانکنش های مولکولی بین اجزاء غشاء و جورشدن آن با کورتکس سلول و ایجاد ساختار و عملکرد در غشاء های سلولی نداریم . چندین دلیل برای خلا آگاهی وجود دارد: اول اینکه، مقیاس-طول مربوط به تشکیل سیستم غشاء- اسکلت سلولی خیلی کوچک است به طوری که با میکروسکوپ نوری دارای قدرت تفکیک محدود قابل حل نیست و ماهیت گذرا بودن آنها گرفتن تصویر مستقیم با استفاده از میکروسکوپ دارای رزولوشن بالا را پیچیده می کند. دوم اینکه ترکیب مولکولی غشاء سلول بسیار پیچیده است( بیش از 500 گونه ی مختلف لیپید، بیش از یکهزار گونه ی قندی و بیش از 400 پروتیین غشایی.). برخلاف پرونیین ها، ما روشی برای تشخیص بسیاری از گونه های درونی قندها و لیپیدها در شرایط سلول زنده نداریم . بنابراین، ما اطلاعات گسترده ی مولکولی برای بسیاری از اجزاء تشکیل دهنده ی غشاء سلولی نداریم . سوم اینکه، سلولهای زنده از نامتعادل هستند و فراینده های ناشی از انرژی به طور مداوم انجام شده و سیستم را بازآرایی می کنند. این فرایندهای فعال، نقل و انتقالات غشایی و متابولیسم و پلیمریزاسیون و انقباض موتوری کورتکس سلول را درگیر می کند. چگونگی جور شدن این فرایندها با ترکیبات و ساختار غشاء سلولی مطلبی است درک جزئی در مورد آن وجود دارد. اخیرا، شبیه سازی های دینامیک مولکولی غشاء ها برای پیش بینی رفتار پایین به بالای غشاء در مقیاس مربوط به تشکیل غشاء خیلی کوچک و کوتاه هستند، این مقیاس حداقل یک میکرومتر و یک ثانیه است. همه ی این حقایق، اندازه گیری مستقیم بسیاری از فرایندها مربوط به غشاء سلولی و بیان آگاهی های به دست آمده از سیستم های مدل حداقل لیپیدها و یا مدلهای MD برای غشاء سلولهای سالم را با چالش مواجه می کند.
اکنون، ما به این نتیجه رسیده ایم که اندیکاتورهای قدرتمندی برای شناسایی اجزاء غشاء سلول وجود دارد. ما این استدلال ها را به صورت سلسله مراتبی ارائه میکنیم که با پیچیدگی میانکنش های مولکولی و خود- سازماندهی (وضعیت پایه) غشاء پلاسمایی شروع میکنیم و به تشکیل دومین های پیام رسان گذرا و دومین های پایدارتر و بزرگتر در زمینه ی عملکردهای سلول می رسیم.
خود سازماندهی غشاءهای ساده و پیچیده
سلولها از مولکول هایی در مقیاس میکروسکوپیک تشکیل می شوند تا امکان کنترل فضا-زمانی واکنش های بیوشیمیایی فراهم شود. اندامک های سلولی به وسیله ی غشاءهای لیپیدی اختصاصی از سیتوپلاسم جدا میشوند این غشاء ها بدیهی ترین شکل تشکیل شدن است. با این وحود، به دلیل ماهیت دو بعدی (2D) و سیال بودنشان ، غشاء ها خودشان ساختارهای ایده الی برای سازماندهی و کنترل واکنش های بیوشیمیایی هستند. در حقیقت، بسیاری از فرایندهای مهم سلولی مانند پیام رسانی، دریافت پیام ، تبدیل انرژی و متابولیسم در غشاء ها اتفاق می-افتد. کاهش ساده ی ابعاد متصل به غشاء های دو بعدی منجر به افزایش موثر در غلظت شده و در نتیجه سرعت واکنش ها را افزایش میدهد و به عنوان سوئیچی برای کنترل برخی از واکنش های پیام رسانی سلولی عمل می-کند. جهت گیری مطلوب مولکول های متصل شونده به غشاء میتواند از طریق بلوکه کردن و یا در معرض قرار دادن جایگاه های واکنش ، واکنش پذیری را افزایش دهد. علاوه بر این قضیه ی عود Pólya تاکید می کند که انتشار دو بعدی تمام سطح را می پوشاند.
علاوه بر این تفاوت های بدیهی بین سیستم های انتشار واکنش در دو و سه بعد ، غشاء های زیستی کیفیت های بیشتری را برای انجام و کنترل واکنش ها فراهم میکند. گردهمایی غشاء ها با واکنش های هیدروفوبیک لیپیدها و بدون نیاز به میانکنش های بین اجزاء همسایه انجام میشود. بسته به ترکیب لیپید ساختار دولایه میتواند به شکل جامد، شبه مایع منظم و یا شبه مایع نامنظم باشد. در غشاء های چند جزئی حتی پیوندهای ضعیف بین اجزاء (بار، تمایل به پیوند هیدروژنی و غیره) میتواند منجر به تفکیک اجزاء و ایجاد دومین هایی با ترکیب اختصاصی شود. علاوه براین ، تطبیق خصوصیات مولکولی اتصال اجزاء غشاء سلولی با ویژگی های موضعی غشاء مانند ضخامت، انحناء، و بار سطحی دسته بندی مولکول ها در غشاء ها را بیشتر تخت تاثیر قرار می دهد. این ویژگی های خود سازماندهی غشاء های لیپیدی در سیستمهای مدل سازی ساده ی غشاء کار شده اند و همه ی این اصول برای عملکرد غشاء سلول مهم ارزیابی شدهاند. غشاء سلولی یک ترکیب لیپیدی پیچیده با انواعی از از پروتیین هاست به طوری که یک سوم از ژن های ما پروتیین های غشایی را کد می کنند. بسته به نوع سلول، و روش اندازه گیری، این پروتیین ها 23 تا 40 درصد از سطح پروتیین را اشغال می کنند.
با محتوی بالای کلسترول و پروتیین، وضعیت کلی غشاء سلولی با میزان لیپید نسبتا بالا به صورت مایع است و در سلولهای غیرقطبی توزیع پروتیین های غشایی مانند گیرنده ها و تریسرهای چربی فلورسنت در مقیاسی بیش از 200 نانومتر همگن به نظر می رسند. با این وجود، اندازه گیری دقیق با رزولوشن بالای لیپید فلورسنت و ردیاب-های پروتیینی در سلولهای زنده ویژگی های انتشار ناهمسان یا کلاستر شدن در مقیاس پایین تر از 200 نانومتر را نشان داده است، که حبس گذرای اجزاء غشاء در اجزاء اسکلت سلولی و دومین های لیپید- پروتیین را نشان می-دهد. شناسایی دومین های لیپید- پروتیینی در مقیاس نانو در سلول های سالم از اندازه گیریهای غیرمستقیم بدست می آید زیرا این دومین ها کوچک و پویا هستند و ساختار آنها به سادگی با فیکساسیون تغییر میکند که برای تکنیک های با رزولوشن بالا ضروری است. اندازه گیری منتشر پروتیین ها و یا لیپیدهای در حال واکنش با نانوکلاسترها نیازمند رزولوشن فضا-زمان بالای است زیرا زمان باقی ماندن مولکول های واحد در نانودومین ها احتمالا کمتر از 100 میلی ثانیه و اندازه ی دومین ها کوچکتر از 60 نانومتر است. رزونانس انتقال انرژی فوستر (FRET) نیز برای تعیین اینکه آیا پروتیینی با نانودومین ها میانکنش دارد یا نه استفاده شده است. از آنجاییکه، تعدا کمی پروتیین در داخل هر کلاستر وجود دارد، FRET یکدست نسبت به FRET دورنگ نتایج ثابت تری را ایجاد می کند. زمان کم میانکنش مولکول هایی که با نانودومین ها در حال انتشار هستند نشان میدهد که انرژیهاس پیوند خیلی بیشتر از انرژی گرمایی kBT نیست. از آنجاییکه ما تنها میتوانیم میانکنش های مولکلوهای واحد با نانودومین ها را اندازه گیری کنیم (اما نمیتوانیم از دومین ها تصویر برداری کنیم) در حال حاضر ما هیچ اطلاعاتی در خصوص طول عمر و پویایی شکل دومین ها نداریم .
نانودومین ها یا ناهمگنی های غشاء سلولی میتواند با دومین های بزرگتر ادغام شود. اتصال عرضی اجزاء پروتیینی یا لیپیدی با توکسین های مالتی والانت یا آنتی بادی ها میکرودومین ها را در غشاء سلولی القا میکند که یاد آور دومین های شبه مایع منظم و شبه مایع نامنظم در غشاءهای مدل است. دومین های مشابه در وزیکول های استخراج شده از غشاء پلاسمایی که در دمای پایین تر از دمای اتاق سرد شده اند مشاهده می شود. این آزمایشات نشان می دهند که ترکیب پیچیده ی غشاء پلاسمایی طوری تکامل یافته تا به یک وضعیت گذار نزدیک شود که درآن برخی از اجزاء از نظر فضا – زمانی از هم جدا هستند. تنوع مایع مشاهده شده در غشاء پلاسمایی میتئواند یکی از راههای نزدیک شدن به این نقطه باشد و جلوگیری از جدا شدن خودبه خوی به این دلیل است که لیپیدهای مختلف انرژی سطح را کاهش میدهند و به عنوان بافر عمل می کنند. علاوه بر این لنگراندازی برخی از اجزاء غشاء سلول به اسکلت سلولی ویا اتصال به ماتریکس خارج سلولی از تفکیک جلوگیری می کند. در زیر با جزئیات بیشتری در خصوص این پدیده بحث خواهیم کرد.
یکی دیگر از جنبه های ساختاری مهم غشاهای سلولی نامتقارن بودن آنهاست. بیشتر اسفنگولیپیدها و گانگلیوزیدها در لایه ی خارجی غشاء ولی بیشتر لیپیدهای دارای بار منفی مانند فسفاتیدیل سرین و گونه های فسفاتیدل اینوزیتول (PIPS) در لایه ی داخلی یافت میشوند. این عدم تقارن به صورت فعال و توسط آنزیم فلیپاز و پروتیین-های انتقال دهنده ی لیپید ایجاد و حفظ میشود. در لایه ی داخلی کلاستر لیپید پروتیین با میانجیگری میانکنش-های الکترواستاتیک بین کاتیون های دو طرفیتی یا موتیف های پروتیینی پلی بازیک انجام میشود که اغلب در نزدیکی سطح سیتوپلاسمی غشاء و گروهای سر لیپیدی دارای بار منفی یافت می شوند. این مکانیسم کلاستری شدن همراه با تبدیل سریع وضعیت فسفریلاسیون PIP به وسیله ی آنزیم ها یک لایه ی تنظیم کننده را برای تشکیل کلاسترهای غشاء پیشنهاد می کند.
روی هم رفته، خصوصیات ترمودینامیکی غشاء ها امکان تفکیک و دسته بندی خود به خودی پروتیین ها و لیپیدها را فراهم میکند. در غشاء های سلولی این خصوصیات باید از نظر فضا-زمان کنترل شود تا عملکرد ایجاد شود. یکی از فرضیات جالب این است که ترکیب پیچیده ی غشاء سلولی همراه با کورتکس سلول یک سیال خوب ترکیب شده را ایجاد می کند که میتواند در آشفتگی های کوچک مانند اتصال لیگاند به کلاسترهای عملکردی بازآرایی کند. علاوه بر این تبادلات آنزیمی گونه های پلی آنیونیک PIP در لایه ی سیتوپلاسمی غشاء یک مکانیسم نیرومندی را برای کنترل تشکیل کلاسترها به وسیله ی میانکنش های الکترواستاتیکی اختصاصی فراهم می کند. هر دو مکانیسم برای پیام رسانی در غشاء پلاسمایی مهم هستند. در حقیقت جور شدن بازآرایی محلی القاء شده با اتصال لیگاند و turnover موضعی PIPS برای ارسال پیام های اتصال لیگاند برای گیرنده های غیر ترانس متصل به GPI (گلیکوزل فسفاتیدیل ایتوزیتول) ضروری است.
نقش داربست ها در سازماندهی غشاء
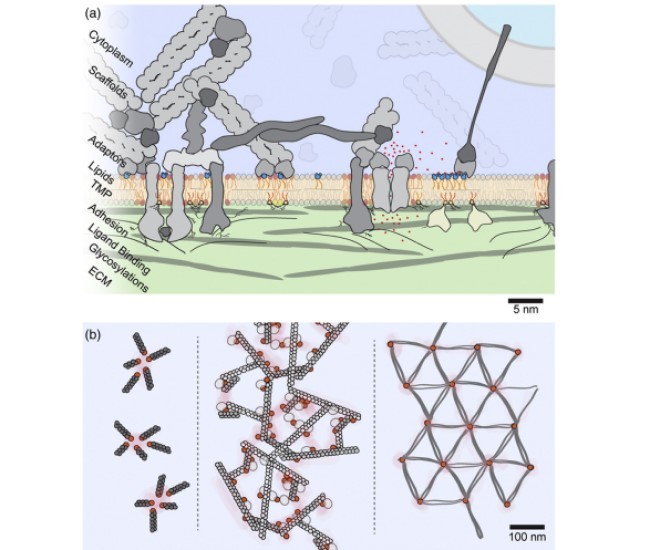
غشاء پلاسمایی یوکاریوتی به وسیله ی انواعی از پروتیین های آداپتور به کورتکس سلول متصل می شود که به پروتیین های ممبران یا لیپیدهای لایه ی داخلی غشاء مانند فسفاتدیل سرین و فسفاتدیل اینوزیتول اتصال دارند. نوع و الگوی لنگراندازی در غشاء پلاسمایی بین انواع سلولها متغییر است و حتی در درون یک سلول واحد، غشاء پلاسمایی اغلب به دومین های ممبران و با یک ساختار کورتکس ویژه تمایز پیدامی کند. میانکنش کورتکس اکتومیوزین با غشاء پلاسمایی ابتدا مکانیک و مورفولوژی سلول را تنظیم می کند. یکی از شناخته شده ترین داربست های غشایی غشاء پلاسمایی اریتروسیت است که به یک شبکه ی شش گوش به خزانه های 100 نانومتری تفکیک می شود. این شبکه از تترامرهای اسپکترین تشکیل شده است که با فیلامنت های کوتاه اکتین دارای اتصال عرضی هستند. فیلامنت های اسپکترین به وسیله ی پروتیین آداپتور آنکرین به پروتیین های گذرنده از عرض غشاء متصل می شوند. اخیرا با استفاده از یک روش میکروسکوپی با وضوح بالا یک ساختار اسکلت غشایی مرتبط در سلولهای آکسون کشف شده است. مانند گلبول های قرمز، داربست اکتین –اسپکترین غشاء پلاسمایی آکسونی را نیز در برگرفته است. با این وجود ، برخلاف گلبولهای قرمز خون، اکتین در اطراف لوله ی آکسونی حلقه تشکیل می دهد. حلقه های اکتین به صورت دوره ای حدود 180نانومتر به وسیله ی تترامرهای اسپکترین جدا می شوند که با آنکرین به کانال های یونی متصل می شوند. در هردو مورد داربست غشایی نیروی مکانیکی ایجاد می کند. در آکسیون ، داربست احتمالا توزیع و حضور پروتیین ها و لیپیدهای غشایی را نیز سازماندهی می کند. در برآمدگی آکسونی، سد بین آکسون و غشاء پیکری (داربست های مشابهی که به کانال های سدیم لنگر می اندازند. ) به اندازه ی کافی ضخیم هستند که از انتشار سایر پروتیین ها و کلاسترها جلوگیری کرده و به لیپیدهای واحد اجازه ی عبور میدهند.
Abstract
Many cell-membrane-associated processes require transient spatiotemporal separation of components on scales ranging from a couple of molecules to micrometers in size. Understanding these processes mechanistically involves understanding how lipids and proteins self-organize and interact with the cell cortex. Here, we review recent advances in dissecting the mechanisms of cell membrane compartmentalization. We introduce the challenges in studying cell membrane organization, the current understanding of how complex membranes self-organize to form transient domains, and the role of protein scaffolds in membrane organization. We discuss the formation of signaling domains as an important example of transient membrane compartmentalization. We conclude by pointing to the current limitations of measuring membrane organization in living cells and the steps that are required to advance the field.
Introduction: Challenges to Studies of the Cell Membrane Organization
Understanding plasma membrane organization has been a major aim in cell biology and biophysics for almost half a century. Despite knowing the majority of the molecular building blocks (lipids, proteins, and sugars) and most of the organization principles, we lack a quantitative understanding of how molecular interactions between membrane components and its coupling to the cell cortex give rise to structure and function in cell membranes. There are several fundamental reasons for this knowledge gap: first, the relevant length scales of compartmentalization in the membrane–cytoskeleton system are too small to be resolved by diffraction-limited light microscopy, and their transient nature complicates direct imaging with super-resolution microscopy [1,2]. Second, the molecular composition of the cell membrane is very complex (N500 different lipid species, N1 k sugar species, and N400 membrane proteins). In contrast to proteins, we lack methods to tag and detect most of the endogenous sugar and lipid species under live-cell conditions. Consequently, we lack molecular distribution information for many components of the cell membrane. Third, living cells are far from equilibrium, energy-driven processes constantly stir and reorganize the system. These active processes involve membrane transport and metabolism and the polymerization and motor-driven constriction of the cell cortex. How these processes couple to the composition and structure of the cell membrane is only partly understood. Lastly, molecular dynamics simulations of membranes are still far too small and short to predict bottom-up membrane behavior on a scale relevant for membrane compartmentalization, which would be at least 1 μm and 1 s [3,4]. All these facts make it very challenging to directly measure many of the relevant processes of cell membranes and to translate the knowledge gained from minimal lipid model systems or MD simulations to the membrane of intact cells.
Still, we argue that there are strong indications for the existence of compartments in the cell membrane. We present the arguments in a hierarchical order starting with the complexity of molecular interactions and the self-organization defining the “ground state” of the plasma membrane and we move up to the formation of transient signaling domains and more stable, larger membrane domains in the context of cell functions.
Self-organization of Simple and Complex Membranes
Cells are compartmentalized from the molecular to macroscopic scale to allow for the spatiotemporal control of biochemical reactions. Cellular organelles separated from the cytoplasm by dedicated lipid membranes are the most obvious form of compartmentalization. However, due to their two-dimensional (2D) and fluid nature, membranes itself are ideal structures to organize and control biochemical reactions. In fact, many important cellular processes take place at membranes, for example, signaling and sensing, energy conversion, and metabolism. The simple reduction of dimensionality upon binding to 2D membranes results in an effective increase in concentration and therefore increases the reaction rates by orders of magnitude, which is, for example, used as a switch to control some cellular signaling reactions [5]. Preferential orientation of membranebound molecules can additionally modulate affinities, either by blocking or exposing interaction sites [6]. In addition, Pólya's recurrence theorem states that 2D diffusion covers the entire surface [7].
Besides these obvious differences between the reaction diffusion systems in three and two dimensions, biological membranes provide more qualities for compartmentalizing and controlling reactions. Membranes assemble via hydrophobic interactions of lipids without the need for attractive interactions between neighboring components. Depending on lipid composition, the emergent bilayer structure can be in a solid, liquid-ordered, or liquid-disordered state. In multicomponent membranes, even weak interactions between components (charge, propensity for hydrogen bonding, etc.) can lead to segregation of components and result in domains of specific composition. In addition, matching molecular characteristics of membranes components to local membrane features like thickness, curvature, and surface charge further influences the sorting of molecules in membranes [8,9] . These self-organization properties of lipid membranes have been worked out in simple model membrane systems, and all of these principles have been suggested to be important for the function of cell membranes. The cell membrane has a very complex lipid composition with a large variety of proteins, as one-third of our genes encode membrane proteins [10]. Depending on cell type and measurement method, these proteins occupy 23% to 40% of the membrane surface [11,12].
With the high cholesterol and high protein content, the overall state of the cell membrane is liquid with relatively high lipid order [13,14], and in non-polarized cells, the distribution of membrane proteins such as receptors and fluorescent lipid tracers appears to be homogenous on scales larger than 200 nm. However, intricate high spatiotemporal resolution measure ments of fluorescent lipid and protein tracers in living cells have revealed anomalous diffusion characteristics or clustering on scales below 200 nm, which indicate the transient confinement of membrane components in cytoskeletal compartments and/or lipid–protein domains on the nanoscale [15–27]. The characterizations of nanoscale lipid–protein domains in intact cells come from indirect measurements because these domains are small and dynamic and their structure is easily perturbed by fixation processes required for higher resolution techniques [16,28–30]. Diffusion measurements of lipids or proteins interacting with nanoclusters require high spatiotemporal resolution, as the residence time of individual molecules in the nanodomains is likely shorter than 100 ms and the domains are smaller than 60 nm. Förster resonance energy transfer (FRET) measurements have also been applied to determine whether a protein interacts with nanodomains. As there are few proteins within each cluster, homo-FRET of the same species has provided more consistent results than dual-color FRET. The short interaction time of diffusing molecules with the nanodomains indicates binding energies not much larger than the thermal energy kBT. [31]. As we can only measure the interaction of individual molecules with nanodomains, but we cannot image the domains, we currently have no information on the lifetime and shape dynamics of the domains [32].
Nanoscale domains or heterogeneities in the cell membrane can coalesce into larger domains. Cross-linking lipid or protein components by multivalent toxins or antibodies induces micrometer-scale domains in the cell membrane, which are reminiscent of liquid-ordered/liquid-disordered domains in model membranes [33]. Similar domains appear in vesicles extracted from the plasma membrane when they are cooled below room temperature [34,35]. These experiments indicate that the complex composition of the plasma membrane has evolved to be close to a transition into a state where some components spontaneously separate. The high lipid diversity found in cell membranes may be one way to be close to this point and yet avoid spontaneous demixing, because the diverse lipids reduce interface energies and act as buffer. In addition, anchoring some cell membrane components to the cytoskeleton or via adhesion to the extracellular matrix has been shown to quench segregation [36]. We will discuss this phenomenon in more detail below.
Another important structural aspect of cell membrane is their asymmetry. Most of the sphingolipids and gangliosides are located on the outer membrane leaflet, while negatively charged lipids like phosphatidylserine and phosphatidylinositol species (PIPs) are found on the inner leaflet. This lipid asymmetry is actively established and maintained by flippases and lipid transport proteins [37,38]. In the inner leaflet, protein and lipid clustering has been shown to be mediated by electrostatic interactions between divalent cations and/or polybasic protein motifs often found close to the cytoplasmic membrane interface and negatively charged lipid head groups. [39–41]. Polyanionic PIPs serve as anchors for proteins locally clustering other lipids and proteins. This clustering mechanism together with the rapid interconversion of the phosphorylation state of PIP species by enzymes [42] offers a regulatory layer to control the formation of membrane clusters.
Taken together, the thermodynamic properties of membranes allow spontaneous segregation and sorting of lipids and proteins. In cell membranes, these properties need to be spatiotemporally controlled to provide function. One interesting hypothesis is that the complex composition of cell membranes together with its coupling to the cell cortex provides an overall well-mixed fluid state, which can be locally reordered into functional clusters upon small perturbations like ligand binding [33]. Additionally, the enzymatic interconversion of polyanionic PIP species in the cytoplasmic membrane leaflet provides a robust mechanism to control cluster formation by specific electrostatic interactions [42]. Both mechanisms have been shown to be important for signaling at the plasma membrane. In fact, the coupling of both ligand-binding-induced local reorganization and local turnover of PIPs has been suggested to be necessary to transduce ligand-binding signals of nontransmembrane, (Glycosylphosphatidylinositol) GPIbound receptors over the plasma membrane [43,44].
Role of Scaffolds on Membrane Organization
The eukaryotic plasma membrane is connected to the cell cortex via a variety of adapter proteins, which bind to membrane proteins and/or inner leaflet lipids like phosphatidylserine and phosphoinositides [45]. The anchoring type and pattern at the plasma membrane vary between cell types, and even within a single cell, the plasma membrane is often differentiated into membrane domains with a specialized membrane cortex structure. The interaction of the actomyosin cortex with the plasma membrane primarily regulates cell mechanics and determines cell morphology. One of the best-studied examples of membrane scaffolds is the erythrocyte plasma membrane, which is compartmentalized into a regular hexagonal lattice with ~ 100 nm compartments [46]. The lattice is composed of spectrin tetramers that are cross-linked by short actin filaments. The spectrin filaments are anchored to transmembrane proteins via the adapter protein ankyrin. A related membrane skeleton structure was recently discovered in neuronal cells using super-resolution microscopy. As in red blood cells, an actin–spectrin scaffold underlies the axonal plasma membrane. However, in contrast to red blood cells, actin forms rings around the circumference of the axonal tube. The actin rings are periodically separated about 180 nm by spectrin tetramers, which are connected to ion channels via ankyrin [47,48]. In both cases, the membrane scaffold provides mechanical robustness. In the axon, the scaffold also possibly organizes the distribution and presence of membrane proteins and lipids. At the axonal hillock, the barrier between axon and soma membrane, a similar scaffold anchors the sodium channels, which are dense enough to block the diffusion of other proteins, and clusters while letting single lipids pass [49].
خلاصه
مقدمه: چالش های پیش روی مطالعه ی سازماندهی غشاء سلولی
خود سازماندهی غشاءهای ساده و پیچیده
نقش داربست ها در سازماندهی غشاء
تشکیل دومین های پیام رسانی
نتیجه گیری
منابع
Abstract
Introduction: Challenges to Studies of the Cell Membrane Organization
Self-organization of Simple and Complex Membranes
Role of Scaffolds on Membrane Organization
Formation of Signaling Domains
Conclusions
References
