
دانلود رایگان مقاله نقشه برداری واکنش پذیری مغز و اعصاب در بیمارانی با گلیومای درجه پایین
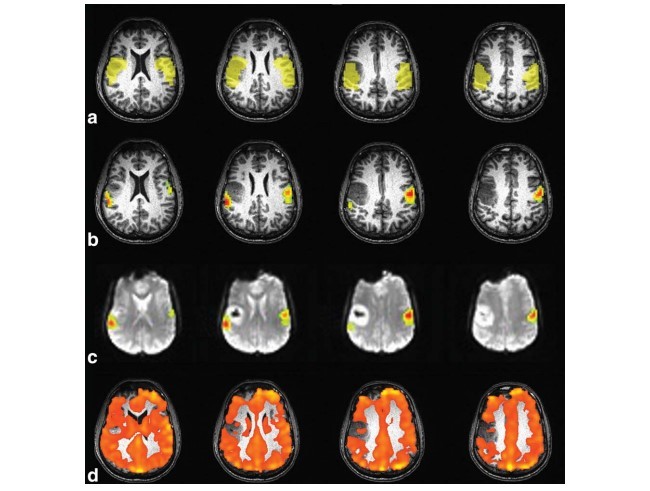
هدف: i- تصدیق نقشهبرداری واکنشپذیری مغز و اعصاب نفسگیری (BHCVR) میزان وابستگی اکسیژن زنی خون (BOLD) بهعنوان روشی مؤثر برای شناسایی عصب عروقی جفت نشده (NVU) در گروهی از بیماران با گلیومای درجه پایین پریرولاندیک تحت MRI عملیاتی پیشگیرانه برای نقشهبرداری حسگر محرک و ii- تشخیص این موضوع که پتانسیل NVU (که توسط نقشهبرداری BH CVR ارزیابیشده) در این گروه توموری شایع است یا خیر.
مواد و روشها: به صورتی بازنگرانه 12 بیمار را مورد ارزیابی قراردادیم که علائم بافتی گلیومای درجه 2 داشتند و چندین کار محرک و یک کار BH انجام دادهاند. نقشههای فعالسازی حسگر محرک و BH CVR در دو حوزه موردتوجه (ROIs) مقایسه شدهاند. این دو حوزه (هم سو با زخم، ipsilesional، و در طرف مقابل زخم، contralesional) بهصورت خودکار تعریفشدهاند.
نتایج: میانگین مقدار T در کار محرک به صورتی چشمگیر در RIO طرف مقابل زخم بالاتر بود. این موضوع در میانگین مقدار T BH نیز برقرار بوده است. تعداد واکسل های فعال به صورتی چشمگیر در ROI طرف مقابل زخم بیشتر بوده است. رواج NVU واقعی 75% بوده است.
نتیجهگیری: نقشهبرداری FMRI حسگر محرک جراحی پیشگیرانه در گلیومای درجه پایین میتواند تحت تأثیر فعالسازی اشتباه نگاتیو مرتبط با NVU قرار گیرد (76% در کارهای تحلیلشده).
نقشهبرداری جراحی پیشگیرانه در حسگر حرکتی پوسته مغز در بیمارانی با زخمی اصلی در مجاورت محدودههای حسگر محرک یکی از کاربردهای اولیه پزشکی در MRI عملیاتی (FMRI) وابستگی سطح اکسیژن زنی خون (BOLD) بوده است. نشان دادهشده که موقعیت دهی پیش عملیاتی در محدودههای پوستهای مشخص توسط FMRI، تأثیری روی مدیریت جراحی بیمار دارد چون منجر به هدایت گزینش ایمنترین مسیر برای دستیابی به زخم و تصمیم مبنی بر اجرای جمجمه برداری در وضعیت خواب یا بیدار میشود. همچنین روی بازدهی، نمایش و انتخاب روش نقشهبرداری عملیات داخلی تأثیر میگذارد. FMRI پیش عملیاتی میتواند برای کمینهسازی خطر آسیبهای دائم و گذرای منطق عصبی پس از عمل و همچنین خطر همراه با گسترش بیماری مرتبط با شبیهسازی پوسته الکتریکی تهاجمی (ECS) مورداستفاده قرار گیرد.
محدودیتی مهم برای کاربردهای درمان گاهی در تصویرسازی عملیاتی این است که BOLD fMRI تنها تغییرات دینامیک خونی همراه با فعالیت عصبی را شناسایی میکند درحالیکه باید خود فعالیت عصبی را مستقیماً تشخیص دهد. نشان دادهشده که جفتشدگی میان فعالیت عصبی و افزایش حجم خون، جریان خون و اکسیژن زنی در همسایگی بافت عروقی در بیمارانی با تومور مغزی یا سایر بیماریهای مغزی دچار اختلال میشوند. ازاینرو شناسایی پوسته مغزی اصلی با BOLD fMRI را دشوار میسازد. این پدیده، از منظر طراحی جراحی عصبی، عوارض درمانگاهی متناسبی دارد زیرا میتواند نگاتیوهای غلطی را ایجاد نماید که میتوانند متعاقباً منجر به قطع پوسته مغزی شود که بهاشتباه برای تابعی خاص، مهم در نظر گرفته نشده است. در ادبیات علمی، مواردی گزارششدهاند که یافتههای نقشهبرداری عمل جراحی با نتایج fMRI پیش از عمل تطابق ندارد و چنین اختلافنظری معمولاً از ویژگیهای NVU بوده است. پیشازاین نشان دادهشده است که NVU چگونه میتواند تأثیری زیاد روی اتکاپذیری نقشههای فعالسازی fMRI در گلیوبلاستومای ناشی از تومور نئووسکولاریتی با ساختار و فیزیولوژی تغییریافته، داشته باشد.
با این حال، در مورد شیوع NVU در بیمارانی با گلیومای درجه پایین و نحوه تحقیق در مورد این موضوع اطلاعات کمی وجود دارد چون این زخمها عموماً ریزش غیرعادی ندارند. آبشار اتصال عصبی عضلانی، برانگیزش عصبی را برای افزایش در حجم خون، جریان خون پیوند میزند و اکسیژن زنی توسط چندین گام ازجمله انتقالدهندههای عصبی تا آستروسیت ها و تا واسطههای شیمیایی و درنهایت ماهیچه نرم عروقی انجام داده میشود.
گلیومای درجه پایین، زخمهایی هستند که بهآرامی رشد پیدا میکنند و غشا مغزی را بهجای نابودسازی، مورد نفوذ قرار میدهد. بنابراین، احتمالاً آبشار اتصال عصبی عضلانی میتواند در هرکدام از سطوح درگیر مختل شود. بررسی NVU در سطوح عصبی یا آستروسیتیک با روشهای تصویرسازی کنونی امکانپذیر نیست. بااینحال، وقفه در آبشار اتصال عصبی عضلانی در هر سطحی همیشه همراه با یک واکنشپذیری ضعیف مغز و اعصاب (CVR) است. این واکنشپذیری را میتوان توسط MRI شناسایی کرد. MRI تغییرات سیگنال BOLD ناشی از کار هیپرکاپنه را اندازهگیری میکند. بنابراین، نقشههای CVR میتوانند در نقشهبرداری پیش از جراحی مفید باشند چون حوزههای بالقوه NVU در مغز را مشخص میکنند. مکانهایی که پاسخ BOLD در آنها نمیتواند استخراج شود. یک از اهداف این مطالعه، تصدیق نقشهبرداری BH CVR بهعنوان ابزاری قابلاعتماد برای شناسایی NVU بالقوه از طریق مقایسه موارد غیرعادی در نقشههای CVR با نقشههای دیدهشده در نقشههای فعالسازی fMRI حسگر حرکتی است. چون انتظار میرود تا کارهای حسگر حرکتی ازجمله حرکتهای دوطرفه، فعالسازی مقاوم دوطرفهای در غشای حسگر حرکتی ارائه دهند. هدفی دیگر، تشخیص این موضوع بود که آیا NVU در گلیوماهای درجه پایین رایج است یا خیر. برای دستیابی به این اهداف؛ گروهی با 12 بیمار با گلیومای درجه پایین پریرولاندیک موردمطالعه قرار گرفتند. این افراد تحت مطالعات نقشهبرداری BH CVR و حسگر حرکتی fMRI بهعنوان بخشی از بررسی کامل fMRI پیش از جراحی قرار گرفتند. علاوه بر این، یافتههای تصویربرداری را با وضعیت عملیاتی درمانگاهی بیمار ارتباط دادیم تا ارزیابی کنیم که آیا یافتههای تصویربرداری حقیقتاً نشاندهنده NVU بودهاند یا تنها پتانسیل NVU را نشان میدادند.
مواد و روشها
بیماران
در این مطالعه، داده از 12 بیمار (5 زن، محدوده سنی = 25 تا 67 سال، میانگین + STDVE = 43.5+ 13.1 سال) بهطور پیشفرض موردمطالعه قرارگرفته است. این بیماران تحت نقشهبرداری fMRI پیش از جراحی در غشای اولیه محرک در موسسه ما قرارگرفتهاند. این مطالعات توسط هیئت بررسی موسسه مورد تأیید قرارگرفته است. معیار قرارگیری افراد در آزمایش، حضور گلیومای جدید درجه I یا II، قرارگرفته در غشای پریرولاندیک و همچنین توانایی بیمار در اجرای کارهای از پیش طراحیشده است. کارهای از پیش طراحیشده در جلسه آموزشی قبل از معاینه fMRI واقعی ارزیابیشدهاند. در جدول 1، سن، جنسیت، چپدستی، موقعیت تومور و بافتشناسی برای هر بیمار در این مطالعه نشان دادهشدهاند.
تصویرسازی MR
اسکن با استفاده از مراحل استاندارد درمانگاهی در سیستم MRI سهگانه زیمنس تسلا 0.3 اجراشده است. این دستگاه مجهز به سیمپیچ ماتریس سر 12 کانالی است. پروتکل تصویرسازی برای تصویرسازی ساختاری شامل توالی تصویرسازی وزن دهی شده T1 سهبعدی و برای تصویرسازی عملیاتی شامل توالیهای تصویرسازی صفحهای اکو-اکو شیب دوبعدی وزن دهی شده BOLD T2* (GE-EPI) میشود. این تصویرسازیها در حالی انجام داده میشدند که بیماران در حال اجرای الگوی نفسگیری (BH) یا محرک بودند. این موارد بهتفصیل در زیر بخش بعدی توضیح دادهشده است.
الگوهای fMRI
تمام بیماران یک یا چند کار محرک و یک کار BH بر ای نقشهبرداری CVR انجام دادهاند. برای نقشهبرداری حوزههای ارائهدهنده دست، یک کار ضربه زنی انگشت (بلوکهای 30-s استراحت در تناوب با بلوکهای 30-s دوطرفه همزمان خود گام انگشتها تا شست، این مقاومت سه بار تکرار شده، مجموعاً 3 دقیقه) و کار فشار دهی دست (بلوکهای 20-s استراحت که در ادامه 20s بهصورت خود گام دست چپ باز و بسته میشود و در ادامه دست راست 20s بهصورت خود گام باز و بسته میشود. این کار 4 بار تکرار شده، مجموعاً 4 دقیقه) مورداستفاده قرارگرفته است. برای نقشهبرداری حوزه ارائهدهنده صورت، از کار حرکت زبان به مدت 3 دقیقه استفادهشده است. این کار شامل بلوکهای 30s استراحت بوده که در ادامه آن بلوکهای 30-s حرکت مکرر عمودی زبان قرار داشته است. این کار 3 بار تکرار شده است. حوزه ارائهدهنده پا با الگویی نقشهبرداری شده است که 3 بار تناوب پیداکرده، 30 s استراحت با 30s خم و راست کردن مچ پا در حالتی خود گام که مجموعاً 3 دقیقه طول کشیده است. در جدول 2، کارهای انجامشده توسط هر بیمار گزارششده است. تعداد و نوع کارها نسبت به هر بیمار تفاوت داشته و وابسته به موقعیت و میزان زخم در غشای پریرولاندیک بوده است. تمامکارهای محرک استفادهشده سعی داشتند تا غشای محرک اولیه و مناطق متناظر غشای سوماتوسنسوری را فعال نمایند. بنابراین، مناطق فعالشده را بانام فعالسازی سوماتوسنسوری میخوانیم. هر بیمار یک کار BH را نیز برای نقشهبرداری CVR انجام داده است. این کار شامل دوره تنفس عادی 40 s بوده که در ادامه آن بلوک 40 s استنشاق و فوراً در ادامه آن دوره 16 s BH قرار داشته است. این چرخه چهار بار تکرار شده است و د ر انتهای آخرین دوره BH، یک دوره اضافی تنفس 20 s اضافه شد. دستورالعملها برای تمامکارها بهصورت بصری داده میشد. هر بیمار بهدقت در جلسهای خارج از اسکنر آموزش داده شدند تا از اجرای صحیح تمامکارها اطمینان حاصل شود. عملکرد کاری بیماران در اسکنر توسط مانیتور LCD خارجی مشاهده شد. این کار بخشی از تجهیزات متداول استفادهشده برای معاینه MRI درمانگاهی در موسسه ما است که در اتاق کنسول قرار دادهشده است.
تحلیل داده
پیشپردازش
داده خام به ایستگاه کاری لینوکس خارجی انتقال داده شد. نرمافزار AFNI و MRIcro برای پردازش تصویر بهکاربرده شدهاند. از تصاویر BOLD EPI، مجموعه دادههای 4D ایجاد شدند. این مجموعه دادهها حاوی مجموعههای زمانی (TS) سیگنال fMRI برای هر واک سل بودند. این TS موقتاً در نظر گرفتهشده تا زمان مالکیت مختلف در هر برش از حجم مغز در نظر گرفته شود. سپس، تمام حجمهای بهدستآمده، از منظر فضایی همراستا شدند تا متناسب با حرکت سر، در جای خود قرار گیرند، با تصاویر ساختاری ثبت شوند و با استفاده از فیلتر گاوسی FWHM ایزوتروپیک 4mm از منظر فضایی هموارشده است. بیشترین جابهجایی فضایی از حجمی که در طول محاسبات تصحیح حرکت بهعنوان مرجع در نظر گرفتهشده، بهعنوان جابهجای بیشینه حرکت سر گزارششده است. این معیار، معیار کنترل کیفیت مهمی بوده که در جدول 2 نشان دادهشده است.
Purpose: (i) to validate blood oxygenation level dependent (BOLD) breathhold cerebrovascular reactivity (BH CVR) mapping as an effective technique for potential detection of neurovascular uncoupling (NVU) in a cohort of patients with perirolandic low grade gliomas undergoing presurgical functional MRI (fMRI) for sensorimotor mapping, and (ii) to determine whether NVU potential, as assessed by BH CVR mapping, is prevalent in this tumor group.
Materials and Methods: We retrospectively evaluated 12 patients, with histological diagnosis of grade II glioma, who performed multiple motor tasks and a BH task. Sensorimotor activation maps and BH CVR maps were compared in two automatically defined regions of interest (ROIs), ipsilateral to the lesion (i.e., ipsilesional) and contralateral to the lesion (i.e., contralesional).
Results: Motor task mean T-value was significantly higher in the contralesional ROIs (6.00 6 1.74 versus 4.34 6 1.68; P ¼ 0.00004) as well as the BH mean T-value (4.74 6 2.30 versus 4.09 6 2.50; P ¼ 0.009). The number of active voxels was significantly higher in the contralesional ROIs (Z ¼ 2.99; P ¼ 0.03). Actual NVU prevalence was 75%.
Conclusion: Presurgical sensorimotor fMRI mapping can be affected by NVU-related false negative activation in low grade gliomas (76% of analyzed tasks).
PRESURGICAL MAPPING OF the sensorimotor cortex in patients with focal lesions in spatial proximity to the sensorimotor areas has been one of the earliest clinical applications of blood oxygenation level dependent (BOLD) functional MRI (fMRI) (1). The preoperative localization of eloquent cortical areas by fMRI has been demonstrated to have an impact on patients’ surgical management because it guides the selection of the safest trajectory to approach the lesion, the decision of whether to proceed with awake or asleep craniotomy, and it can also influence the efficiency, exposure, and choice of technique for intraoperative mapping (2,3). Preoperative fMRI can also be used to minimize the risk of transient or permanent postsurgical neurological deficits as well as the risk of associated morbidity related to invasive electrocortical stimulation (ECS) (4).
For clinical applications of functional imaging, a critical limitation is that BOLD fMRI only detects hemodynamic changes accompanying neuronal activity rather than directly detecting the neural activity itself. The coupling between neuronal activity and the increase in blood volume, blood flow and oxygenation occurring in the adjacent vasculature has been reported to be disrupted in patients with brain tumors or other cerebral diseases, thereby making it difficult, if not impossible, to detect eloquent cortex with BOLD fMRI (5). This phenomenon, known as neurovascular uncoupling (NVU), has relevant clinical consequences from the neurosurgical planning standpoint because it can generate false negatives that can subsequently lead to the resection of cortex erroneously deemed as not critical for a particular function. In the literature, cases have been reported where the findings of intraoperative mapping did not match the results of presurgical fMRI, and such discordance was often attributed to NVU (6). It has already been demonstrated how NVU can dramatically affect the reliability of the fMRI activation maps in glioblastomas due to tumor neo vascularity with altered structure and physiology (7).
However, little is known regarding the prevalence of NVU in patients with low grade gliomas and how it could be investigated because these lesions are not generally characterized by abnormal perfusion. The neurovascular coupling cascade linking neuronal firing to increase in blood volume, blood flow, and blood oxygenation occurs through multiple steps involving neurotransmitters to astrocytes to chemical mediators and finally vascular smooth muscle (8).
Low grade gliomas are slowly growing lesions that are known to infiltrate rather than destroy the cerebral cortex; therefore, it is possible that the neurovascular coupling cascade may be disrupted at any of the many involved levels. It is not possible to investigate NVU at the neuronal or astrocytic levels with currently available imaging techniques. However, the interruption of the neurovascular coupling cascade at any level will always be associated with an impaired cerebrovascular reactivity (CVR) that can be detected by MRI measuring the BOLD signal change due to a hypercapnia task. Maps of CVR might, therefore, be helpful in presurgical mapping because they determine areas of potential NVU in the brain where the BOLD response cannot be elicited. One purpose of this study was to validate BH CVR mapping as a viable tool for NVU potential detection through comparison of abnormalities on CVR maps to those seen on sensorimotor fMRI activation maps, because sensorimotor tasks involving bilateral movements are expected to yield robust activation bilaterally in the sensorimotor cortex (9). Another purpose was to determine whether NVU is prevalent in low grade gliomas. For these purposes, we studied a group of 12 patients with perirolandic low grade gliomas who underwent both BH CVR mapping and fMRI sensorimotor activation studies as part of a comprehensive presurgical fMRI examination. Furthermore, we correlated the imaging findings with the patients’ clinical functional status to assess whether the imaging findings were truly indicative of NVU or simply NVU potential.
MATERIALS AND METHODS
Patients
Data from twelve patients (5 females, age range ¼ 25– 67 years, mean 6 stdev ¼ 43.5 6 13.1 years) who underwent presurgical fMRI mapping of the primary motor cortex at our institution were retrospectively analyzed in this study that was approved by our Institutional Review Board. Inclusion criteria were the presence of a de novo grade I or grade II glioma located in the perirolandic cortex and patient’s ability to perform the prescribed tasks as assessed in a training session preceding the actual fMRI examination. In Table 1, age, sex, handedness, tumor location, and histology are reported for each patient included in the study.
MR Imaging
Scanning was performed using standard clinical sequences on a 3.0 Tesla (T) Siemens Trio MRI system (Siemens Medical Solutions, Erlangen, Germany) equipped with a 12-channel head matrix coil. Imaging protocol included a three-dimensional (3D) T1 weighted imaging sequence (TR ¼ 2300 ms, TI ¼ 900 ms, TE ¼ 3.5 ms, 9 flip angle, 24-cm field of view, 256 256 176 acquisition matrix, slice thickness 1 mm) for structural imaging and multiple 2D gradient echo-echo planar imaging (GE-EPI) T2* weighted BOLD sequences for functional imaging (TR ¼ 2000 ms, TE ¼ 30 ms, 90 flip angle, 24-cm field of view, 64 64 33 acquisition matrix, slice thickness 4 mm with 1 mm gap between slices) run while patients were performing a motor or a breathhold (BH) paradigm as described in more detail in the following subsection.
fMRI Paradigms
All patients performed one or more motor tasks and a BH task for CVR mapping. To map the hand representation areas a finger tapping task (30-s blocks of rest alternating with 30-s blocks of simultaneous bilateral self paced fingers to thumb opposition repeated 3 times, total duration 3 min) and a hand squeezing task (20-s blocks of rest followed by 20 s of self-paced opening and closing of the left hand in turn followed by 20 s of self-paced opening and closing of the right hand repeated 4 times, total duration 4 min) were used. To map the face representation area a 3-minlong tongue movement task was used, consisting of 30-s blocks of rest followed by 30-s blocks of repetitive vertical tongue movement repeated 3 times. The foot representation area was mapped with a paradigm where patients alternated 3 times 30 s of rest with 30 s of flexing and extending their ankles at a self-paced rate, total duration 3 min. In Table 2, the tasks performed by each patient are reported. The number and type of tasks varied from patient to patient and was dependent on the location and extent of the lesion in the perirolandic cortex. All of the motor tasks used tend to activate both the primary motor cortex and the corresponding regions of primary somatosensory cortex; thus, we refer to the activated regions as “sensorimotor activation.” Each patient performed also a BH task for CVR mapping including a normal breathing period of 40 s followed by a 4-s block of inspiration that immediately preceded a 16-s BH period (10). This cycle was repeated four times and at the end of the last BH period an additional normal breathing period of 20 s was added. Instructions for all tasks were visually cued. Each patient was accurately trained in a session outside the scanner to make sure that all tasks could be correctly performed. Patients’ task performance in the scanner was observed through an external LCD monitor, that is part of the routine equipment used for clinical MRI examinations at our institution, located in the scanner console room.
Data Analysis
Preprocessing
Raw data were exported to an external Linux workstation. AFNI (11) and MRIcro software (http:// www.mccauslandcenter.sc.edu/mricro/mricron/) was used for image processing. From the acquired BOLD EPI images 4D datasets were created containing the fMRI signal time series (TS) for each voxel. These TS were temporally interpolated to account for the different acquisition time of each slice in one brain volume. Then all the acquired volumes were spatially realigned to correct for head motion, coregistered to the structural images and spatially smoothed using a 4-mm isotropic FWHM Gaussian filter. The maximum spatial displacement from the volume taken as reference during motion correction calculation was reported as “Head motion maximum displacement,” an important quality control (QC) metric included in Table 2.
مواد و روشها
بیماران
تصویرسازی MR
الگوهای fMRI
تحلیل داده
پیشپردازش
تحلیل AMPLE
ارزیابی پتانسیل NVU در برابر NVU واقعی
نتایج
مباحثه
منابع
MATERIALS AND METHODS
Patients
MR Imaging
fMRI Paradigms
Data Analysis
Preprocessing
AMPLE Analysis
Assessment of NVU Potential versus Actual NVU
RESULTS
DISCUSSION
REFERENCES
با فرمت pdf و ورد ترجمه به همراه اصل مقاله به زبان انگلیسی
