
دانلود رایگان مقاله داربست های طبیعی برای تمایز کلیوی سلول های بنیادی جنینی انسان
چکیده
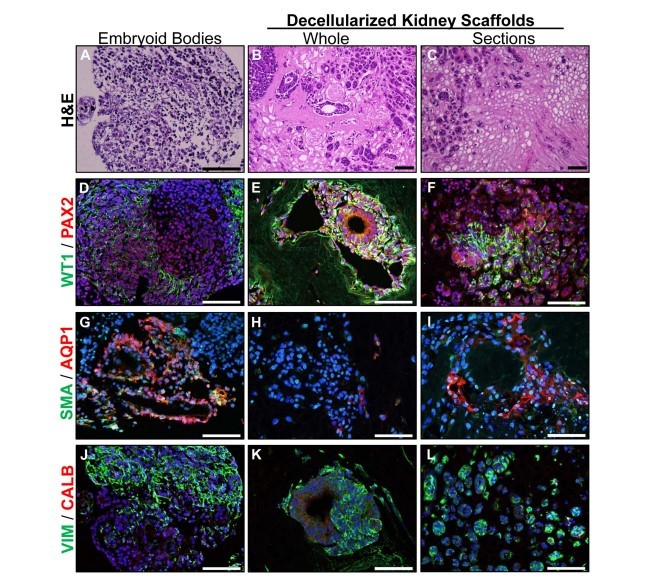
با وجود شور و شوق برای مهندسی زیستی پیوند زدن بافت های عملکردی کلیه، موانع بسیاری قبل از تحقق پتانسیل این فن آوری در یک محیط بالینی باقی مانده است. استراتژی های مهندسی بافت زنده برای کلیه به شناسایی جمعیت های سلولی لازم، داربست های کارآمد و شرایط کشت سه بعدی برای توسعه و حمایت از معماری منحصر به فرد و عملکرد فیزیولوژیکی این عضو حیاتی نیاز دارد. مطالعات ما قبلا نشان داده اند که بخش سلول زدایی شده کلیه های میمون رزوس در همه گروه های سنی, یک ماتریکس خارج سلولی طبیعی (ECM) را با خواص ساختاری کافی با تاثیرات فضایی و سازمانی روی مهاجرت و تمایز سلول های بنیادی جنینی انسان (hESC) را ارائه می دهند. برای بررسی بیشتر استفاده از داربست های کلیه طبیعی غیرسلولی شده برای مهندسی بافت کلیوی، hESC پرتوان به طور کلی یا روی بخش های ECM کلیه و مهاجرت سلولی و فنوتیپ در مقایسه با روش های تمایز تعیین شده برای hESC کشت داده شدند. نتایج qPCR و تجزیه و تحلیل های ایمونوهیستوشیمی, تنظیم مثبت نشانگرهای سویه کلیوی را نشان داد, زمانی که hESC بدون سیتوکین یا تحریک فاکتور رشد در داربست های غیرسلولی شده کشت داده شدند، که نقش ECM در جهت دهی به تمایز سویهکلیوی را نشان می دهد. hESC نیز با فاکتورهای رشد متمایز شد و در هنگام کاشت روی ECM کلیوی یا یک داربست پلی ساکارید جدید بیولوژیکی بی اثر برای بلوغ بیشتر مقایسه شد. نشانگرهای سویه کلیوی به تدریج در طول زمان روی هر دوی داربست ها تنظیم مثبت شدند و نشان داده شد که hESC, ژن های امضای ساز کلیوی، توبول پروگزیمال، اندوتلیال، و جمعیت های مجرای جمع آوری را بیان می کند. این یافته ها نشان می دهند که داربست های طبیعی, بیان نشانگرهای سویه کلیوی را به خصوص در مقایسه با کشت جنینی بدن ارتقا می دهند. نتایج این مطالعات نشاندهنده قابلیت های یک داربست پلی ساکارید جدید برای کمک به تعریف یک پروتکل برای تمایز جد کلیه از hESC، و پیشرفت وعده مهندسی بافت به عنوان یک منبع از بافت عملکردی کلیه است.
مقدمه
زمینه در حال گسترش مهندسی بافت, نویدبخش خلق بافت و اندام با خواص کاربردی و پتانسیل درمانی تقریباً برای هر بافت از بدن انسان است. استراتژی های مهندسی اولیه به طور خاص برای ساختارهای لوله ای مانند رگ های خونی [1، 2]، مثانه ادراری [3] ، حنجره [4]، و نای موفق بوده اند [5]. نیاز بالینی برای تعویض بافت های عملکردی برای فهرست در حال انتظار بیماران پیوند عضو, فوریتی است و به ویژه برای بیماران در حال انتظار برای دریافت کلیه حیاتی است؛ افراد نیازمند یک کلیه > 80٪ تمام بیماران در فهرست در حال انتظار را تشکیل می دهند (http://optn.transplant.hrsa.gov). قابل ذکر است که کلیه که بیشترین تقاضا را دارد, با توجه به معماری پیچیده، یک طیف از فنوتیپ های سلول، توابع چندگانه، و فقدان یک جمعیت سلول های بنیادی / پیش ساز ایجاد شده در بزرگسالان که از آن کلیه را می توان بازسازی نمود, یکی از چالش برانگیز ترین بافت های تحت مهندسی است. استراتژی های مهندسی بافت زنده برای کلیه به شناسایی جمعیت های سلولی لازم، داربست های مناسب برای ارائه پشتیبانی از خواص ساختاری و سازمانی فضایی و زمانی، و همچنین ترکیبات محیط/ رشد عامل / کشت برای حفظ رشد و عملکرد فیزیولوژیکی بافت مهندسی شده نیاز دارد.
یک روش امیدوار کننده برای مهندسی بافت کلیوی شامل استفاده از داربست های طبیعی تولید شده توسط غیرسلولی نمودن کلیه های اهدا کننده می شود. فرآیند غیرسلولی نمودن معمولاً یک داربست بیولوژیکی سه بعدی (سه بعدی) با مولکول های ماتریکس خارج سلولی مادری (ECM) در مکان های هندسی مناسب و مجراهای عروقی سالم تولید می کند. از زمان مطالعات اثبات مفهوم اولیه [6]، داربست های کلیه غیرسلولی شده در موش ها [07/11]، پستانداران غیر انسانی [12-13]، خوک ها [14-18] و کلیه های جسد انسان تولید شده اند که در تحقق معیارهای پیوند زدن [8، 19-21] ناموفق بوده اند. همچنین مطالعات, حضور دیگر عوامل بیولوژیک [22] از جمله عوامل رشد، سیتوکین [10-11، 20]، و پپتیدهای زیست فعال را نشان داده اند که می توانند به نفع رشد و بلوغ عملکردی سلول های درون ساختار باشند. با وجود وعده این رویکرد, بسیاری از چالش ها از جمله تعیین یک منبع مناسب از سلول ها برای سلولی نمودن دوباره، بهینه سازی سیستم های کشت بافت برای ساختاری مهندسی بافت در حال توسعه، روشن نمودن نقش و مطلوبیت ECM بومی در هدایت سرنوشت سلول، و تعریف یک نقطه پایانی بلوغ مناسب قبل از پیوند زدن در داخل بدن [23] باقی می ماند. با توجه به کمبود کلیه های دهنده دردسترس, استراتژی های مهندسی بافت با مواد داربست طبیعی که برای این نیاز تنظیم شده اند می توانند انتقال بالینی را تسهیل نمایند.
مطالعات ما قبلاً نشان داد که بخش های رزوس کلیه میمون غیرسلولی شده در همه گروه های سنی (جنین تا مسن), یک ECM طبیعی را با خواص ساختاری کافی برای حمایت از مهاجرت سلولها از جداکشت کلیه به شیوه ای وابسته به سن فراهم می کنند [12، 13]، و مطلوبیت این داربست ها, تأثیرات فضایی و سازمانی بر مهاجرت و تمایز سلول های بنیادی جنینی انسان (hESC) [22] ارائه می دهند. برای بررسی بیشتر به استفاده از داربست های غیرسلولی شده کلیوی برای مطالعات رشد در شرایط ازمایشگاهی، بیماری، و به عنوان مهندسی جایگزین بافت، استراتژی هایی برای بهبود سلولی نمودن دوباره بررسی شدند. توانایی داربست های غیرسلولی شده کلیه برای تاثیر در مهاجرت سلولی و فنوتیپ با hESC تمایز نیافته کاشته شده در بخش های کلیه در مقابل کل کلیه ها مورد مطالعه قرار گرفت. برای مطالعات بر روی سلولی نمودن دوباره کل کلیه ها, تحویل سلول ها از طریق شریان کلیوی و یا حالب ارزیابی شدند. علاوه بر این، برای ارزیابی نقش داربست در هدایت تمایز کلیوی hESC، سلول ها روی بخش های کلیه غیرسلولی شده کاشته شدند و با فنوتیپ سلولی در سلول های به دست آمده در هنگام استفاده از یک داربست آلی پلی ساکارید فیزیولوژیکی بی اثر مقایسه شدند.
مواد و روشها
جمع آوری بافت
هیچ حیوانی در این مطالعه گنجانده نشد. یک مخزن زیستی در بخش های میمون رزوس کلیه قبلا به دست آمده و یا کل کلیه ها برای این مطالعات مورد استفاده قرار گرفت. نمونه ها از طریق برنامه تدارک بافت (www.cnprc.ucdavis.edu/our-services) به دست آمدند (N=12 گنجانده شده در این مطالعه).
آماده سازی داربست
کل کلیه ها و یا بخشی از کلیه ها با استفاده از پروتکل های زیر غیرسلولی شده شد. کل کلیه ها برای غیرسلولی نمودن به شرح زیر پرفیوژن شدند: (1) 100 USP/ml Heparin (Sagent Pharmaceuticals, Schaumburg, IL) در نمک بافرشده فسفات (PBS; Life Technologies, Grand Island, NY) در 1 میلی لیتر / دقیقه به مدت 15 دقیقه. (2) 1٪ دودسیل سولفات سدیم (SDS, Life Technologies) در آب مقطر 5 تا 20 میلی لیتر / ساعت (بر اساس اندازه کلیه، به عنوان مثال، ~ 5-10 گرم کلیه با نرخ جریان 5 میلی لیتر / ساعت برای 3-4 روز با حجم پرفیوژن کل ~ 350-500 میلی لیتر) تا زمانی که بافت شفاف بود و حلال غیرسلولی نمودن تخلیه از ارگان, بی رنگ بود؛ و (3) 1X آنتی بیوتیک-ضد قارچ (Life Technologies) در شستشوی PBS در 1 تا 20 میلی لیتر / ساعت برای 72-96 ساعت. مقاطع عرضی کلیه نیز در PBS به دست آمد (ضخامت 2-3 میلی متر) و به طور مختصر شستشو شدند و در 1٪ SDS برای 5-8 روز در دمای 4 درجه و یا روی یک تکان دهنده پیوسته برای 48-72 ساعت در دمای اتاق تا شفاف شدند غیرسلولی شده. حلال SDS روزانه تغییر کرد تا زمانی که غیرسلولی نمودن تکمیل شد. برای غیرسلولی نمودن در 4 درجه, مقاطع و حلال های SDS قبل از جایگزینی SDS به دمای اتاق آورده شدند. مقاطع کلیه در دمای اتاق در روتاتور به شرح زیر شسته شدند: (1) 1X آنتی بیوتیک-ضد قارچ در PBS به مدت 24 ساعت (تکرار 3 بار). (2) اتانول 70٪ به مدت 24 ساعت؛ و (3) 1X آنتی بیوتیک-ضد قارچ در PBS به مدت 24 ساعت. هر دو بخش غیرسلولی شده و کل کلیه ها در دمای 4 درجه در PBS با 1X حلال آنتی بیوتیک-ضد قارچ تا سلولی نمودن دوباره نگهداری شدند. قبل از استفاده، 8 میلی متر قطر بیوپسی پانچ (Fisher Scientific) برای بخش های غیرسلولی شده کلیه برای اطمینان از سازگاری در ابعاد داربست استفاده شد. دیسک های پلی ساکارید (PSS; GroCell-سه بعدیTM, Molecular Matrix, Inc., Davis, CA) با 8 میلی متر شعاع و 2-3 میلی متر ضخامت به عنوان یک ماتریس داربست پلی ساکارید سه بعدی بی اثر برای مقایسه استفاده شدند.
سلول ها
تمام مطالعات hESC توسط UC Davis Stem Cell Research Oversight Committee تایید شدند. معرف ها و محیط ها از Life Technologies و مکمل های فاکتور رشد از R&D Systems خریداری شدند مگر آنکه در غیراینصورت ذکر شده بود . خط hESC فدرال تایید شده WA09 (H9, WiCell Research Institute) روی فیبروبلاست های جنینی موش تحت تابش با توجه به پروتکل های ایجاد شده در Dulbecco’s Modified Eagle Medium (DMEM) تکمیل شده با 20٪ Knockout Serum Replacer (Life Technologies) ، 2 MML-گلوتامین ، 0.1 میلی متر اسیدهای آمینه، 0.1 میلی متر β-مرکاپتواتانل، و 4 از ng / ml فاکتور رشد فیبروبلاست 2 (FGF2) [24] حفظ شد.
سلولی نمودن دوباره
کلیه های کلی غیرسلولی شده با hESC در یک بیوراکتور سفارشی سیستم- بسته شده طراحی شده برای جاری ساختن محیط اکسیژن در یک نرخ جریان ثابت از طریق شریان کلیوی و / یا حالب دوباره جمعیت دهی شدند. داربست توسط پرفیوژن با محیط رشد اندوتلیال با مکمل ها (EGM2, Lonza, Allendale, NJ) به مدت حداقل 24 ساعت قبل از کاشت سلول تهویه شد. hESC برای کاشت با استفاده از کلاژناز برای حذف کولونی ها از تک لایه تغذیه کننده-سلول آماده شد. پس از سانتریفوژ کردن برای حذف کلاژناز، hESC به یک تعلیق تک-سلولی با معرف تفکیک سلول StemPro Accutase (Life Technologies) برای 2-3 دقیقه تفکیک شد. هنگامی که سلول های تک مشاهده شدند، فرایند تفکیک با اضافه نمودن این محیط خنثی شد. پس از سانتریفوژ کردن، سلول ( ) در 1 میلی لیتر محیط دوباره معلق شدند، در یک سرنگ بارگذاری شدند، و در یک داربست از طریق یک پورت دسترسی بیوراکتور 3-راهه در نرخ جریان 0.1 میلی لیتر / دقیقه تزریق شدند. پس از کاشت، پرفیوژن ساختار به مدت 2 ساعت جهت اتصال سلولها متوقف شد. کشت راکتور (37 درجه سانتی گراد، 5٪ CO2) و پرفیوژن ساختار (نرخ جریان 0.1 میلی لیتر / دقیقه) پس از آن تا 7 روز برای ارزیابی توزیع سلول حفظ شد. برای مطالعات در مورد سلولی نمودن دوباره از طریق حالب، لوله بندی برای اتصال حالب کانوله به یک پورت واقع در خارج از راکتور استفاده شد و از طریق آن سلول ها به طور دستی تزریق شدند.
بخش های کلیه برای کاشت توسط غوطه ور شدن در EGM2 به مدت 24 ساعت پس از قرار گرفتن در یک صفحه 12 تهویه شدند و به آرامی با یک سواب استریل نوک-پنبه ای برای حذف محیط اضافی محو شدند. همانطور که در بالا در یک سیستم تعلیق تک-سلولی توصیف شده است, hESC آماده شد و در 10 میکرولیتر از محیط دوباره معلق شد و به آرامی بر روی سطح بخش-داربست پیپت شد. داربست های کاشته شده به مدت 2 ساعت به انکوباتور بازگردانده شدند تا اتصال سلولها میسر شود و پس از آن محیط اضافی به لبه های چاه ها اضافه شد تا اطمینان حاصل شود که سطح داربست در واسط هوا-محیط حفظ شده است. محیط کشت هر 3 روز تغییر کرد و مقاطع کلیه تا 3 هفته کشت داده شدند.
Abstract
Despite the enthusiasm for bioengineering of functional renal tissues for transplantation, many obstacles remain before the potential of this technology can be realized in a clinical setting. Viable tissue engineering strategies for the kidney require identification of the necessary cell populations, efficient scaffolds, and the 3D culture conditions to develop and support the unique architecture and physiological function of this vital organ. Our studies have previously demonstrated that decellularized sections of rhesus monkey kidneys of all age groups provide a natural extracellular matrix (ECM) with sufficient structural properties with spatial and organizational influences on human embryonic stem cell (hESC) migration and differentiation. To further explore the use of decellularized natural kidney scaffolds for renal tissue engineering, pluripotent hESC were seeded in whole- or on sections of kidney ECM and cell migration and phenotype compared with the established differentiation assays for hESC. Results of qPCR and immunohistochemical analyses demonstrated upregulation of renal lineage markers when hESC were cultured in decellularized scaffolds without cytokine or growth factor stimulation, suggesting a role for the ECM in directing renal lineage differentiation. hESC were also differentiated with growth factors and compared when seeded on renal ECM or a new biologically inert polysaccharide scaffold for further maturation. Renal lineage markers were progressively upregulated over time on both scaffolds and hESC were shown to express signature genes of renal progenitor, proximal tubule, endothelial, and collecting duct populations. These findings suggest that natural scaffolds enhance expression of renal lineage markers particularly when compared to embryoid body culture. The results of these studies show the capabilities of a novel polysaccharide scaffold to aid in defining a protocol for renal progenitor differentiation from hESC, and advance the promise of tissue engineering as a source of functional kidney tissue.
Introduction
The expanding field of tissue engineering provides hope for the creation of tissue and organs with functional properties and therapeutic potential for nearly every tissue of the human body. Initial engineering strategies have been successful, particularly for tubular structures such as blood vessels [1, 2], urinary bladder [3], larynx [4], and trachea [5]. The clinical need for functional tissue replacements is urgent for patients on the organ transplant waiting list and is particularly critical for patients waiting for a kidney; individuals in need of a kidney represent >80% of all patients on the waiting list (http://optn.transplant.hrsa.gov). It is notable that the kidney which is in greatest demand is also one of the most challenging tissues to engineer due to complex architecture, a spectrum of cell phenotypes, multiple functions, and a lack of an established stem/progenitor cell population in adults from which the kidney can be regenerated. Viable tissue engineering strategies for the kidney requires identification of necessary cell populations, suitable scaffolds to provide structural support and spatiotemporal organizational properties, as well as medium/growth factor/culture combinations to sustain growth and physiological function of the engineered tissue.
One promising approach for renal tissue engineering involves the use of natural scaffolds produced by decellularization of donor kidneys. The decellularization process typically produces a three-dimensional (3D) biological scaffold with native extracellular matrix (ECM) molecules in proper geometric locations and intact vascular conduits. Since initial proof-ofconcept studies [6], decellularized kidney scaffolds have been produced in rats [7–11], nonhuman primates [12–13], pigs [14–18], and from cadaveric human kidneys failing to meet criteria for transplantation [8, 19–21]. Studies have also demonstrated the presence of other biologic agents [22] such as growth factors, cytokines [10–11, 20], and bioactive peptides that may be advantageous to growth and functional maturation of cells within the construct. Despite the promise of this approach many challenges remain including determination of a suitable source of cells for recellularization, optimization of in vitro culture systems for the developing tissueengineered construct, elucidating the role and utility of the native ECM in directing cell fate, and defining an appropriate maturational endpoint prior to in vivo transplantation [23]. Given the shortage of available donor kidneys, tissue engineering strategies with natural scaffolding materials that are tailored to the need may further facilitate clinical translation.
Our studies have previously demonstrated that decellularized rhesus monkey kidney sections of all age groups (fetal to aged) provide a natural ECM with sufficient structural properties to support migration of cells from kidney explants in an age-dependent manner [12, 13], and the utility of these scaffolds to provide spatial and organizational influences on human embryonic stem cell (hESC) migration and differentiation [22]. To further explore the use of decellularized renal scaffolds for ex vivo studies of development, disease, and as engineered tissue replacements, strategies to improve recellularization were assessed. The ability of decellularized kidney scaffolds to influence cell migration and phenotype was studied with undifferentiated hESC seeded in sections of kidney versus whole kidneys. For studies on the recellularization of whole kidneys the delivery of cells through the renal artery or the ureter were assessed. In addition, to evaluate the role of the scaffold in guiding hESC renal differentiation, cells were seeded on decellularized kidney sections and compared with the cellular phenotype of cells obtained when using an organic, physiologically inert polysaccharide scaffold.
Materials and Methods
Tissue Collection No animal subjects were involved in the study. A biorepository of previously obtained rhesus monkey kidney sections or whole kidneys were used for these studies; specimens were obtained through the tissue procurement program (www.cnprc.ucdavis.edu/our-services) (N = 12 included in the study).
Scaffold Preparation
Whole kidneys or sections of kidneys were decellularized using the following protocols. Whole kidneys were perfused for decellularization as follows: (1) 100 USP/ml Heparin (Sagent Pharmaceuticals, Schaumburg, IL) in phosphate buffered saline (PBS; Life Technologies, Grand Island, NY) at 1 ml/minute for 15 minutes; (2) 1% sodium dodecyl sulfate (SDS, Life Technologies) in distilled water at 5 to 20 ml/hour (based on kidney size, e.g., ~5–10 g kidney with flow rate of 5 ml/hour for 3–4 days with a total perfusion volume of ~350–500 ml) until the tissue was transparent and the decellularization solution draining from the organ was colorless; and (3) 1x antibiotic-antimycotic (Life Technologies) in PBS wash at 1 to 20 ml/hour for 72–96 hours. Transverse kidney sections were also obtained (2–3 mm thickness) and rinsed briefly in PBS and decellularized in 1% SDS for 5–8 days at 4°C or on a continuous shaker for 48–72 hours at room temperature until translucent. SDS solution was changed daily until decellularization was completed. For decellularization at 4°C the sections and SDS solutions were brought to room temperature prior to SDS replacement. Sections of kidneys were washed at room temperature on a rotator as follows: (1) 1x antibiotic-antimycotic in PBS for 24 hours (repeated 3 times); (2) 70% ethanol for 24 hours; and (3) 1x antibiotic-antimycotic in PBS for 24 hours. Both the decellularized sections and whole kidneys were stored at 4°C in PBS with 1x antibiotic-antimycotic solution until recellularization. Prior to use, an 8 mm diameter biopsy punch (Fisher Scientific) was used for the decellularized kidney sections to ensure consistency in scaffold dimensions. Polysaccharide discs (PSS; GroCell-3DTM, Molecular Matrix, Inc., Davis, CA) with 8 mm diameter and 2–3 mm thickness were utilized as an organic, inert 3D polysaccharide scaffold matrix for comparison.
Cells
All hESC studies were approved by the UC Davis Stem Cell Research Oversight Committee. Medium and reagents were purchased from Life Technologies and growth factor supplements from R&D Systems unless otherwise noted. The federally approved hESC line WA09 (H9, WiCell Research Institute) was maintained on irradiated mouse embryonic fibroblasts according to established protocols in high glucose Dulbecco’s Modified Eagle Medium (DMEM) supplemented with 20% Knockout Serum Replacer (Life Technologies), 2 mM L-glutamine, 0.1 mM nonessential amino acids, 0.1 mM β-Mercaptoethanol, and 4 ng/ml fibroblast growth factor 2 (FGF2) [24].
Recellularization
Decellularized whole kidneys were repopulated with hESC in a closed-system custom bioreactor designed to perfuse oxygenated medium at a constant flow rate through the renal artery and/or the ureter. The scaffold was conditioned prior to cell seeding by perfusion with endothelial growth medium with supplements (EGM2, Lonza, Allendale, NJ) for at least 24 hours. hESC were prepared for seeding with the use of collagenase to remove colonies from the feeder-cell monolayer. After centrifugation to remove collagenase, hESC were dissociated to a single-cell suspension with StemPro Accutase cell dissociation reagent (Life Technologies) for 2–3 minutes. Once single cells were observed, the dissociation process was neutralized with the addition of medium. Following centrifugation, cells (20x106 ) were resuspended in 1 ml of medium, loaded into a syringe, and infused into the scaffold via a 3-way bioreactor access port at 0.1 ml/minute flow rate. After seeding, perfusion of the construct was halted for 2 hours to allow time for cell attachment. Bioreactor culture (37°C, 5% CO2) and perfusion of the construct (flow rate 0.1 ml/minute) was then maintained for up to 7 days to assess cell distribution. For studies on recellularization via the ureter, tubing was used to connect the cannulated ureter to a port located outside the bioreactor and through which cells were manually infused.
Kidney sections were preconditioned for seeding by soaking in EGM2 for 24 hours then placed in a 12-well plate and gently blotted with a sterile cotton-tipped swab to remove excess medium. hESC were prepared as described above in a single-cell suspension and were resuspended in 10 μl of medium and gently pipetted onto the section-scaffold surface. Seeded scaffolds were returned to the incubator for 2 hours to allow time for cell attachment after which additional medium was added to the edges of the wells in order to ensure that the surface of the scaffold was maintained at the air-medium interface. Culture medium was changed every 3 days and kidney sections were cultured for up to 3 weeks.
