
دانلود رایگان مقاله عکسبرداری راکتیویتی عروق مغزی
چکیده
خلاصه: این مقاله مروری روششناسی عکسبرداری راکتیویتی عروق مغزی نفس نگهداشتن را از نظرکسب و تحلیل توضیح میدهد و کاربردهای این روش در عکسبرداری قبل جراحی مخصوصاٌ با توجه به سطح اکسیژن خون وابسته به fMRI را بررسی میکند. اصلیترین کاربردش در fMRI بالینی، برای ارزیابی پتانسیل غیرجفتشدگی مغزیعروقی میباشد. غیرجفتشدگی مغزیعروقی بصورت بالقوه یک محدودیت عمدهء fMRI بالینی، مخصوصاً در حالت ضایعات تودهای مغز مانند تومورهای مغزی و بدشکلیهای عروق داخل مغزی است که با ناهنجاریهایی در همودینامیک موضعی هم در حالت اکتسابی یا مادرزادی همراه هستند. همینطور، بازنمایی نفسنگهداشتن راکتیویتی عروقمغزی یک جز ضروری از تحلیل کنترل کیفی fMRI تشکیل میدهد مخصوصاً وقتی که برای بازنمایی قبل جراحی قشر سخنوری اجرا شود. همچنین چالشهای کربن دیاکسید مصنوعی مورد استفاده در بازنمایی راکتیویتی عروق مغزی مورد بحث قرار خواهد گرفت و کاربردهایش در ارزیابی ذخیره عروق مغزی و بیماری عروق مغزی توصیف خواهد شد.
جفتشدگی عصبیعروقی اساسی برای وابستگی میزان خون اکسیژن (BOLD) میباشد که به واکنش عروق کوچک به فعالیت عصبی و پیامد کاهش موضعی در غلظت دياكسيهموگلوبين اشاره دارد و از اکسیژنرسانی بیشتر در عروق کوچک نسبت مصرف اکسیژن در نورونهای مجاور تحریک شده منتج میشود. در واقعیت، موج BOLD توسط تعامل پیچیده تغییرات در CBV، CBF، میزان متابولیک مغزی مصرف اکسیژن و دیگر فاکتورهایی همچون میرایی مویرگی، سخت شامه، هماتوکریت تعیین میشود. این جفتشدگی عصبیعروقی یک آبشار پیچیده از وقایع را در سطوح ریزساختاری، بیوشیمی، الکتروفیزیولوژی دربر میگیرد که بسیاری از اجزا همچون آستروسیتها، انتقالدهندههای عصبی و میانجیهای شیمیایی به علاوه نورونهای پروگزیمالی و عروق دیستالی ماهیچه صاف را دربرمیگیرد. بررسیهای عالی این موضوع توسط کوهلر وهمکاران در سال 2009 و آتول وهمکاران درسال 2010 ارائه شده است. در حالت عادی تصور میشود انتقالدهندههای عصبی مانند گلوتامات که از سیناپسها آزاد شده، با گیرندههای مجزایی روی آسروسیتها یا نورونها ترکیب میشود و منجر به آزادسازی میانجیهای شیمیایی متفاوت از هرکدام از آنها میشود و سپس مستقیماً کشش سرخرگی ماهیچه صاف را تحت تأثیر قرار میدهد. برای مثال نیتریت دی اکسید که از نورونها آزاد میشود و پروستاگلاندین که از آستروسیتها رهاسازی میشود، میتوانند منجر به اتساع عروق شوند. با این وجود، جفتشدگی عصبیعروقی پیچیده و دارای فرآیند درک است که مسیرهایی چندگانه ارسال موج را دربرمیگیرد. سازوکارهای ارسال موج آستروسیت یکی از این مسیرهاست که افزایش سطوح کلسیم آستروسیت را شامل میشود.
در حالیکه افراد داوطلب سالم برای BOLD fMRI مطالعه میشوند و مطالعات fMRI، بیماران فاقد ناهنجاری همودینامیک موضعی شریانی یا رگهای وریدی را دربر میگیرد، آبشار جفتشدگی عصبیعروقی میتواند به عنوان سالم در نظرگرفته شوند، لزوماً یکسانی در بیماران دارای ضایعات تودهای داخلی مغزی، AVM مغزی، سکتههای مغزی یا بیماری عروقمغزی درست نیست. در این موارد آخری، آبشار جفتشدگی عصبیعروقی ممکن است در هر سطحی از پروگزیمال انتهایی نورونی (در شرایطی که قشر دچار اختلال یا غیرقابل دوام) به واکنش عروق کوچک دیستالی تجزیه شود. این پدیده، به جدا شدگی عصبیعروقی یا جفتنشدگی عصبیعروقی (NVU) اشاره دارد. در اکثر موارد که فعالیت الکتریکی بصورت مداوم ارائه میشود اماهنوز در قشر بیمارشده، تجزیه ممکن است در آستروسیتها، انتقالدهندهها یا در اغلب موراد عروق اندام انتهایی اتفاق بیفتد. در این موارد، ارزیابی راکتیویتی عروقمغزی (CVR) میتواند یک روش مفید برای شناسایی پتانسیل NVU باشد. NVU مشکلی بحرانی در fMRI قبل جراحی است زیرا میتواند به عنوان فعالسازی منفی کاذب در وظایف BOLD fMRI ظاهر شوند. برخلاف محیط تحقیق، که معمولاً روی کاهش مثبت کاذب (خطای آماری نوع 1) با استفاده از آستانههای آماری دقیق یا با استفاده اصلاحات مقایسات چندگانه تأکید دارد، در fMRI قبل جراحی بالینی، تأکید روی جلوگیری از منفیهای کاذب (خطاهای نوع دو) میباشد. فعالسازی منفی کاذب در fMRI بالینی میتواند منجر به پیامدهای جدی شود زیرا ممکن است منتج به برش غیرعمدی قشر سخنوری مغز شود که BOLD خاموش یا پنهان را روی تصاویر فعالسازی BOLD ظاهر میکند. زیرا ممکن است ناتوان از نمایش یک پاسخ BOLD قوی یا حتی حداقل به یک محرک نورونی مناسب باشد. مشابهاً، در برخی موارد ممکن است NVU نتیجه دهد، در فعالسازی مثبت کاذب که میتواند منجر به برشهای نامناسب یک ضایعه همچون تومور شود، و این ممکن است بصورت منفی پیشآگهی کلی بیمار را تحت تأثیر قرار دهد. در چنین شرایطی، توانایی شناسایی NVU، ممکن است برای مراقبت بیمار حیاتی باشد، زیرا ممکن است استفاده از ارزیابی الکتروفیزیولوژیک مکمل (تصویربرداری محرک کورتیکال حین جراحی) برای تصویربرداری قابل اعتماد قشر سخنوری مغز ضروری باشد.
به خوبی پیبردهاند که در موارد گلیومای درجه بالا، رگزایی تومور با فعالیت غیرعادی رگ و نفوذپذیری رگهای جدید همراه است، بنابراین NVU پدیدهای شناسایی شده در زیرمجموعه بیماران مبتلا به تومور مغزی است. با این وجود، اخیراً پیبردهاند که NVU مشابه همچنین میتواند با تومورهای درجه پایینتر رخ بدهد. در مورد گلیومای درجه پایین، سازوکار واقعی مسئول NVU شفاف نیست اما ممکن است با اختلال عملکرد آستروسیتی وابسته به تومورهای ارتشاحی همراه باشد. شیوع NVU در تومورهای مغزی براساس مجموعههای اخیر کاملاً بالاست، اگر چه مثالهایی در این مجموعهها برآورد میکنند که NVU ممکن است ضرورتاً پدیده همه-یا-هیچ (جفتی) نباشد، اما تا حدی ممکن است با درجههای متغیر نشان داده شود که منجر به درجههای متغیر کاهش فعالسازی BOLD ضایعات مورد انتظار در مواضع قشری سخنوری و فقدان کامل فعالسازی قابل شناسایی فقط در برخی موراد میشود. شناسایی چنین پتانسیل NVU برای تفسیر مناسب تصویرهای فعالسازی BOLD fMRI حیاتی است زیرا فعالسازی منفی-کاذب ممکن است بسته به آستانههای آماری مورد استفاده نشان داده شوند. NVU مشابه میتواند در AVMها به دلیل اختلالات همودینامیک موضعی که با فرسودگی ذخیره ثانویه عروقی در شنتگذاری سرخرگی-وریدی مرتبط است، از دست دادن فشار نفوذ و گرفتگی وریدی دارای مقاومت بالای جریان خارجی مشاهد شود.
تکنیک تصویربرداری نفس نگهداشتن راکتیوتیتی عروق مغزی
اگرچه چالشهای کربن دیاکسید بالا (هایپرکاپنه) در اتباط با تصویر برداری BOLD را در ارزیابی اثربخش CVR مغزی استفاده کردهاند، معیار تکنیک استاندارد برای چنین تصویربرداری CVR تجویز گاز کربن دیاکسید (CO2) در حین تصویربرداری MR بوده است. تکنیک نفس نگهداشتن (BH) یک جایگزین سادهتر را پیشنهاد میکند که برای پیادهسازی در محیط بالینی آسانتر است و هنوز میتواند افزایش مشابهی را افزایش سطوح کربن دیاکسید شریانی ایجاد کند و نتایجی مشابه تصاویر مفید BOLD CVR همانند آنها با استفاده از تکنیکهای تنفس گاز حاصل شود. این تکنیک BH کوتاه مدت معمولاً دامنه از 10-30 ثانیه، را دربر میگیرد که با دورههای تنفس معمولی جایگزین میشود. حتی BHهایی که خیلی کوتاهتر هستند (کمتر از 3 ثانیه) ممکن است حالتهای مختصری از کربن دیاکسید بالا را ایجاد کنند که منجر به تغییرات قابل اندازهگیری موج BOLD میشود اما توانمندی پاسخ BOLD و تعداد وکسلها در قشر مغزی که تغییرات موج BOLD را نشان میدهند با افزایش طول مدت BH افزایش مییابد. علاوه براین، قابلیت تکثیر چنین پاسخهای BOLD بزرگتر است و تغییرپذیری حین اسکن با دورههای طولانیتر BH به حداقل رسیده است. در حالیکه BH با دورههای 20 تا 30 ثانیه ممکن است برای داوطلبان سالم عملی باشد، در برخی بیماران مبتلا به تومورهای مغزی، یک توافق ممکن است میان طول مدت مطلوب BH و محدودیتها راحتی/مقاومت بیمار ضروری باشد. خوشبختانه، بررسیهای داوطلبان سالم نشان دادند که استفاده از بلوکهای تنفس آهسته میان بلوکهای موفقیتآمیز BH یک خط قاعده BOLD پایدارتر را ارائه میدهند که پاسخ موج نفس نگهداشتن BOLD میتواند استخراج شود و منجر به ارزیابی صحیحتر و کاهش تغییر پذیری حین اسکن را درپیدارد.
دیگر مطالعات برآورد کردند که استفاده از BHهای انتهای-بازدم قابلیت تکثیر بیشتری را نسبت به تکنیکهای BH انتهای -دم درپی دارد، زیرا بازدم انتهایی یک وضعیت معادل قاعده طبیعی بیشتر را ارائه میدهد که دیافراگم، ریهها و دیواره سینه را قبل از آغاز چالش BH دربرمیگیرد. توماسون و گلور برآورد کردند، پاسخ BOLD که از بازدم BH حاصل میشود کمی متفاوت با دم-انتهایی BH میباشد که در دومی یک پاسخ BH بیشتر از دو مرحلهای را دربرمیگیرد و کمتر مطلوب است. یک محدودیت عمده درک شده از تکنیکهای BH برای عکسبرداری CVR مشکل تکرارپذیری ضعیف مرتبط با انطباق در محیط بیماران آسیب دیده عصبی میباشد. برخلاف تجویز بیرونی CO2 که ارزیابی کمی از فشار ناقص کربن دیاکسید و فشار ناقص سطوح اکسیژن و تجویز کنترل شده CO2 تنفس شده را مختصر میکند، با تکنیکهای BH میتواند تضمین شود، عملکرد بیماران میتواند بصورت قابل توجهی تحت تأثیر این پارامترها قرار بگیرد. جهت رفع این نگرانیها، برایت و مورفی 12 داوطلب سالم که یک کار BH را انجام دادند، مورد بررسی قرار گرفتند درجهها متفاوت از کار انطباق با ثبت سپری شدن خودشان() سطوح گاز O2 و CO2 شبیهساز کردند. آنها بیان کردند که در حالیکه تمام چالشهای BH با تأثیر کمبود اکسیژن متوسط همراه هستند، علاوه بر کربن دیاکسید بالای خون بصورت عمدی، اثر کمبود اکسیژن حداقل است و با استفاده از انتهای جاری CO2 به عنوان یک پسرو در تحلیل مدل خطی عمومیشان، اندازهگیریهای قابل تکرار تغییر موج BOLD به عنوان مقیاس CVR ممکن بود. خوشبختانه این نتایج با نتایج تانکردی و هوج سازگار بود، که الگوی BH مشابه را استفاده کردند و گزارش دادند که هایپوکسی متوسط ناشی از کار BH بصورت معناداری نتایج CVR آنها را تحت تأثیر قرار نمیدهد.
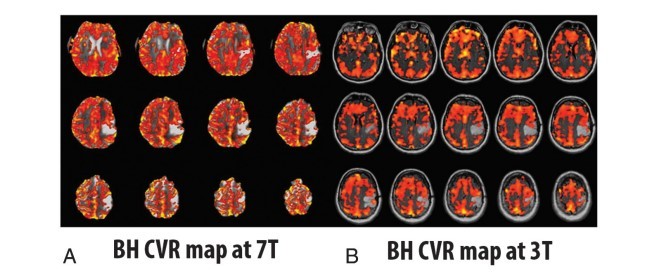
در جان هاپکینز، ما پروتکل BH CVR را توسعه دادیم که بصورت موفقیتآمیز تقریباً در 95% بیمارانی اجرا کردیم که بطور روتین زیر معاینات عکسبرداری قبل جراحی BOLD fMRI بالینی در طول چهار سال گذشته میرفتند. این تکنیک بلوکهای BH 16 ثانیهای را استفاده میکند که همواره تغییرات دقیق موج BOLD را با حداقل راحتی بیمار تولید میکند. بلوکهای تنفسی منظم طولانیتر (کنترلی) به معادلسازی موج BOLG متعاقب هر چالش هایپرکاپنه BH اجازه میدهد. برخلاف پروتکل مورد استفاده برایت و مورفی، که BHهای انتهای بازدمی را استفاده میکنند، در موسسه ما BH انتهای دمی را هماهنگ کردیم، زیرا در تجربه ما ، برای بیماران آسیب دیده عصبی اجرای BH انتهای دمی آسانتر است. ما یک دم 4 ثانیهای کنترل شده، آهسته را قبل از دوره 16ثانیه BH استفاده میکنیم که سپس با بلوک 40 ثانیهای نفس عمیق کشیدن عادی پیگیری میشود، این چرخه 4 بار تکرار میشود و در انتهای آخرین دورهء BH، یک دورهء 20 ثانیه تنفس عادی برای یک کل کار مدت 4 دقیقه و 20 ثانیهای سازماندهی شده است.
تحلیل دادههای BH BOLD به آسانی با استفاده از رویکرد عمومی مدل خطی انجام شده است. با این وجود، مدلسازی عملکرد پاسخ همودینامیک براساس عملکرد پاسخ همودینامیکی برین وهمکاران جهت مدل اختصاصی پاسخ همودینامیکی برای کار BH است. این مدلسازی بلوکهای تنفس معمولی نسبتاً طولانیتری را در نظر میگیرد که برای معادلسازی موج BOLDهر چالش هایپرکاپنه مورد نیاز هستند. در موسسه ما، یک استاندارد دوبعدی BOLD تنها-شیب عکس-اکو EPI T2-وزن دهی شده برای کار BH روی سیستم تصویر برداری 3T MR با پارامترهای زیر استفاده میشود : , TE _ 30 ms, flip angle _ 90°, 24-cm FOV, TR _2000 ms ماتریکس کسب 646464 ، بخش ضعیف 4-mm دارای فاصله بین بخشی 1-mm .
مزایای تکنیک BH در بیماران دارای آسیبهای عصبی در مقایسه با روشهای تجویزی CO2 برونزا، زمان تنظیم تجهیزات برای اسکنر تصویربرداری MR داخلی یا خارجی مورد نیاز نیست و نیازی به استفاده کانال بینی یا ماسک صورت وجود ندارد. استفاده ماسک صورت به عنوان یک بخش مدارهای تنفسی یا سیستم ارائه دهنده گاز ممکن است برای بیماران دارای آسیبها عصبی ناخوشایند باشد که ممکن است تحت چالش چندگانه نمونههای فعالسازی عملکردی BOLD مشابه با طول مدت جلسه تصویربرداری MR قرار میگیرند، مخصوصاً دارای محدودیتهای فیزیکی اضافی هستند که توسط نوارهای سر ، بالشتک سر، هدفونها و عینک ایمنی ویدئو یا دیگر سختافزار نمایش تحریک fMRI (مانند صفحه نمایشها/آینههای تعبیه شده روی نوار سر هنگامی که سیستم پروژکتوری استفاده میشوند) تحمیل میشوند.
ABSTRACT
SUMMARY: This review article explains the methodology of breath-hold cerebrovascular reactivity mapping, both in terms of acquisition and analysis, and reviews applications of this method to presurgical mapping, particularly with respect to blood oxygen level– dependent fMRI. Its main application in clinical fMRI is for the assessment of neurovascular uncoupling potential. Neurovascular uncoupling is potentially a major limitation of clinical fMRI, particularly in the setting of mass lesions in the brain such as brain tumors and intracranial vascular malformations that are associated with alterations in regional hemodynamics on either an acquired or congenital basis. As such, breath-hold cerebrovascular reactivity mapping constitutes an essential component of quality control analysis in clinical fMRI, particularly when performed for presurgical mapping of eloquent cortex. Exogenous carbon dioxide challenges used for cerebrovascular reactivity mapping will also be discussed, and their applications to the evaluation of cerebrovascular reserve and cerebrovascular disease will be described.
Neurovascular coupling is the basis for the blood oxygen level– dependent (BOLD) effect, which refers to the microvascular response to neural activation and the consequent regional decrease in deoxyhemoglobin concentration resulting from greater oxygen delivery to the microvasculature than oxygen consumption by the stimulated adjacent neurons.1-3 In reality, the BOLD signal is determined by a complex interaction of changes in CBV, CBF, and the cerebral metabolic rate of oxygen consumption and other factors such as capillary attenuation and diameter and hematocrit.4 This neurovascular coupling involves a complex cascade of events at the microstructural, biochemical, and electrophysiologic levels, which includes many components such as astrocytes, neurotransmitters, and chemical mediators in addition to neurons proximally and vascular smooth muscle distally.5 Excellent reviews of this topic have been provided by Koehler et al, 2009,5 and Attwell et al, 2010.6 In general, it is thought that neurotransmitters such as glutamate that are released at synapses bind to separate receptors on astrocytes and neurons and result in release of various chemical mediators from each that then directly affect arteriolar smooth-muscle tone. For example, nitric oxide released from neurons and prostaglandins released from astrocytes can result in vasodilation.6 However, neurovascular coupling is a complex and incompletely understood process that involves multiple signaling pathways, including astrocytic signaling mechanisms involving increases in astrocytic calcium levels.5
While in healthy volunteer BOLD fMRI studies and fMRI studies involving patients without regional hemodynamic alterations or abnormalities of arterial or venous vasculature, the neurovascular coupling cascade can be assumed to be intact, the same is not necessarily true for patients with intracranial mass lesions, brain AVMs, cerebral infarctions, or cerebrovascular disease. In these latter cases, the neurovascular coupling cascade may break down at any level from the proximal neuronal end (in the case of nonviable or impaired cortex) to the distal microvascular response. This phenomenon is referred to as neurovascular decoupling or neurovascular uncoupling (NVU). In most cases in which electrical activity is present in viable but nevertheless diseased cortex, the breakdown may occur at the astrocytic, neurotransmitter, or, most often, the vascular “end organ” level. In these cases, evaluation of cerebrovascular reactivity (CVR) can be a use ful method for detection of NVU potential. NVU is a critical problem in presurgical fMRI because it can manifest as false-negative activation on BOLD fMRI tasks. Unlike in the research setting, where the emphasis typically is on reduction of false-positives (type I statistical errors) by use of stringent statistical thresholds or use of corrections for multiple comparisons, in clinical presurgical fMRI, the emphasis is on the avoidance of falsenegatives (type II errors). False-negative activation on clinical fMRI can lead to serious consequences because it may result in inadvertent resection of eloquent cortex that appears BOLD-“silent” or -“invisible” on BOLD activation maps because it may be incapable of displaying a robust or even minimal BOLD response to an appropriate neural stimulus. Similarly, NVU may result, in some cases, in false-positive activation that could result in insufficient resection of a lesion such as a tumor, and this may adversely affect the patient’s overall prognosis. In such a setting, the ability to detect NVU may be critical for patient care because it may necessitate the use of complementary electrophysiologic evaluation (ie, intraoperative cortical stimulation mapping) for the reliable mapping of such eloquent cortex.
It is well-known that in cases of high-grade glioma, tumor angiogenesis is associated with abnormal vasoactivity and permeability of the neovasculature; thus, NVU is a recognized phenomenon in this subset of patients with brain tumor.7 However, it has recently been demonstrated that similar NVU can occur with lower grade tumors as well.8-10 In the case of low-grade gliomas, the exact mechanism responsible for the NVU is not clear but may be associated with astrocytic dysfunction related to the infiltrative tumors. The prevalence of NVU in brain tumors is quite high according to recent series,8-10 though the examples in these series suggest that NVU may not necessarily be an all-or-none (ie, binary) phenomenon, but rather may be present to variable degrees, resulting in variable degrees of reduction of expected ipsilesional BOLD activation in eloquent cortical regions and complete absence of detectable activation only in some cases.10 Detection of such NVU potential is critical for adequate interpretation of clinical BOLD fMRI activation maps because false-negative activation may be present, depending on the statistical thresholding used. Similar NVU can be seen in AVMs due to regional hemodynamic abnormalities related to the exhaustion of vascular reserve secondary to arteriovenous shunting and loss of perfusion pressure or venous congestion with high outflow resistance.
The Breath-Hold Cerebrovascular Reactivity Mapping Technique
Although hypercapnia challenges have been used in conjunction with BOLD imaging to very effectively evaluate brain CVR, the criterion standard technique for such CVR mapping has been exogenous carbon dioxide (CO2) gas administration during MR imaging.11-13 The breath-hold (BH) technique offers a simpler alternative that is easier to implement in the clinical setting and yet can produce similar increases in arterial CO2 levels and resultant similarly useful BOLD CVR maps as those achieved by using gas-inhalation techniques.14 This technique involves short-duration BHs, typically in the range of 10 –30 seconds, which alternate with periods of normal breathing. Even BHs that are much shorter (eg, as short as 3 seconds) may produce brief states of hypercapnia that result in measurable BOLD signal changes, but the robustness of the BOLD response and the number of voxels in the brain cortex displaying BOLD signal changes increase with the increasing duration of the BH.13,15 In addition, the reproducibility of such BOLD responses is greater and interscan variability is minimized with longer BH periods.13,16While BHs in the range of 20 –30 seconds may be feasible for healthy volunteers, in some patients, such as those with brain tumors, a compromise may be necessary between ideal BH duration and patient comfort/tolerance limits. Furthermore, healthy volunteer studies have shown that the use of blocks of paced breathing between successive BH blocks provides a more consistent BOLD baseline from which the breath-hold BOLD signal response can be extracted, resulting in more accurate assessment and reduced interscan variability.13,17
Other studies have suggested that use of end-expiration BHs results in greater reproducibility than end-inspiration BH techniques because end-expiration offers a more natural resting equilibrium state involving the diaphragm, lungs, and chest wall before initiation of a BH challenge.13,17 Thomason and Glover18 have even suggested that the BOLD response resulting from endexpiration BHs is slightly different from that of end-inspiration BHs in that the latter involves more of a biphasic BOLD response, which is less desirable.13 One major perceived limitation of BH techniques for CVR mapping is the problem of compliance-related poor repeatability in the setting of neurologically impaired patients. Unlike with exogenous CO2 administration, where precise quantitative assessment of partial pressure of carbon dioxide and partial pressure of oxygen levels and controlled administration of inhaled CO2 can be assured, with BH techniques, patient performance can substantially affect these parameters. To allay these concerns, Bright and Murphy13 studied 12 healthy volunteers who performed a BH task simulating differing degrees of task compliance with recording of their expired (end-tidal) gas O2 and CO2 levels. They noted that while all BH challenges are associated with a mild hypoxia effect in addition to the intended hypercapnia, the effect of the hypoxia is minimal, and by using endtidal CO2 as a regressor in their general linear model analysis, repeatable measurements of BOLD signal change as a measure of CVR were possible.13 Furthermore, their results are consistent with those of Tancredi and Hoge,19 who used a similar BH paradigm and reported that the mild hypoxia induced by the BH task did not significantly affect their CVR results.
At Johns Hopkins, we have developed a BH CVR protocol that has been successfully implemented in approximately 95% of patients who have undergone routine clinical BOLD fMRI presurgical mapping examinations during the past 4 years. The technique uses 16-second BH blocks that produce consistently robust BOLD signal changes with minimal patient discomfort. The much longer regular breathing (control) blocks allow equilibration of the BOLD signal following each BH hypercapnia challenge. Unlike the protocol used by Bright and Murphy,13 which used end-expiration BHs, at our institution we have adopted endinspiration BHs because in our experience, it has been easier for neurologically impaired patients to perform end-inspiration BHs. We use a slow, controlled 4-second inspiration before a 16-second BH period, which is then followed by a 40-second block of selfpaced normal breathing; this cycle is repeated 4 times, and at the end of the last BH period, an additional 20-second period of normal breathing is incorporated for a total task duration of 4 minutes 20 seconds.
Analysis of BH BOLD data is easily accomplished by using a general linear model approach; however, the modeling of the hemodynamic response function is based on the hemodynamic response function proposed by Birn et al20 to specifically model the hemodynamic response to a BH task. This modeling takes into account the relatively longer normal breathing blocks that are required for equilibration of BOLD signal following each hypercapnia challenge. At our institution, a standard 2D single-shot gradient-echo EPI T2*-weighted BOLD sequence is used for the BH task on a 3T MR imaging system with the following parameters: TR 2000 ms, TE 30 ms, flip angle 90°, 24-cm FOV, 64 64 33 acquisition matrix, 4-mm section thickness with 1-mm intersection gap.10
The advantages of the BH technique in patients with neurologic impairment, compared with exogenous CO2 administration methods, are that no equipment setup time is needed either outside or within the MR imaging scanner and there is no need for the use of a nasal cannula or facemask. Use of facemasks as part of breathing circuits or gas delivery systems may be uncomfortable for neurologically impaired patients who may be undergoing multiple challenging BOLD functional activation paradigms in the same lengthy MR imaging session, especially with additional physical constraints imposed by the use of a head coil, head padding, headphones and video goggles, or other fMRI stimuluspresentation hardware (eg, screens/mirrors mounted on a head coil when projector systems are used).
چکیده
تکنیک تصویربرداری نفس نگهداشتن راکتیوتیتی عروق مغزی
کاربردهای تصویربرداری BH CVR برای عکسبرداری قبل جراحی
فیزیولوژی و ذخیره عروق مغزی CVR
کاربرد محرک اتساع عروق CO2
نتیجهگیری
منابع
ABSTRACT
The Breath-Hold Cerebrovascular Reactivity Mapping Technique
Applications of BH CVR Mapping to Presurgical Mapping
CVR Physiology and Cerebrovascular Reserve
Application of Vasodilatory CO2 Stimuli
CONCLUSIONS
REFERENCES
