
دانلود رایگان مقاله مقایسه ترسیم واکنش پذیری عروق مغزی و تصویربرداری پرفیوژن
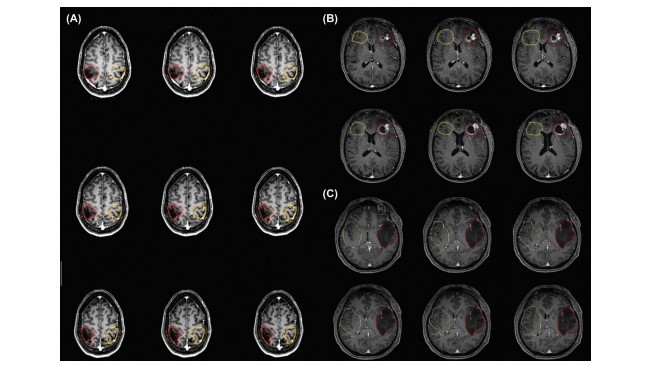
مکانیسم جفت شدن شلیک نورونی و انبساط مغزی عروقی میتواند به صورت معناداری در بیماریهای مغزی با یکدیگر تلاقی شود که این تشخیص مناطق قشری نزدیک یا درون ضایعات قابلبرداشت را با استفاده ازfMRI وابسته به سطح اکسیژن خون دچار مشکل میکند. چندین فاکتور متابولیک و عروقی برای توصیف این جداسازی عصبی و عروقی القاء شده توسط ضایعه مدنظر قرارگرفتهاند، اما فعلاً هیچ استاندارد تصویربرداری برای کشف NUV وجود ندارد. در هر، در مطالعات ام آر آی بالینی این ضروری است که خطر NUV مورد ارزیابی قرار گیرد زیرا حضور NUV ممکن است منجر به فعالسازی منفی کاذب شود که خود منجر به برش سهوی کورتکس eloquent و کمبود نورولوژیک دائمی بعد از عمل خواهد شد. اگرچه NUV از قطع یک یا چند جزء از آبشار جفت کننده عصبی و عروقی پیچیده سلولی و شیمیایی (NCC) ناشی میشود، تصویربرداری MR تنها قادر است که مرحله نهایی را در این NCC که شامل پاسخ مغزی_ عروقی نهایی است را ارزیابی کند. از آنجایی که هر چیزی که واکنش مغزی_ عروقی را دچار اختلال کند الزاماً منجر به NVU خواهد شد، صرفنظر از تأثیر آن در NCC، ما میتوانیم ترسیم CVR را به عنوان نشانگری که نمایندهای از پتانسیل NVU است در نظر بگیریم. ما فرض کردیم که ترسیم BOLD CVR که با نگه داشتن تنفس همراه است میتواند نشانگر بهتری از پتانسیل NVU نسبت به قابلیت دینامیک T₂ تصویربرداری MR پرفیوژن گادولینیوم کنتراست باشد. زیرا دومی با این عنوان شناخته می شود که تنها خطر NVU مرتبط با درجه بالایی از غده مغزی را با مشخص کردن حجم خون مغزی بالا و جریان خون مغزی مرتبط با رگ زایی تومور را منعکس می کند. در هر حال از آنجایی که درجه پایین و متوسط غده های مغزی با چنین هایپرپرفیوژن های تومورال مرتبط نیستند، ترسیم کردن BOLD BH CVR ممکن است قادر به کشف چنین پتانسیل های NVU حتی در گلوماهای با درجه پایین بدون رگ زایی باشدکه نشانه ای از غده گلیایی است. در هر حال، مشخص شده است که غدد گلیایی با NVU متغییری در ارتباط هستند زیرا رگ زایی ممکن است همیشه منجر به NVU نشود. متریک های پرفیوزن که توسط تصویر برداری MR پرفیوژن گادولینیوم T₂ به دست آمده اند با درصد BOLD از تغییر سیگنال در طرح های BH CVR در یک گروه از 19 بیمار با تومورمغزی درون جمجمه ای با میزان و ماهیت متفاوت مقایسه شدند. ماکسیمم پیکسل مجزای rCVB و rCBF در مناطق holotumoral مورد توجه به صورت مشابه نیمکره ای متمرکز بافت نرمال عادی سازی شدند. علاوه بر این، تغییر سیگنال درصد درطرح های BH CVR در درون ipsilesion ROI به صورت تغییر سیگنال درصددر درون ROI مشابه contralesional عادی سازی شدند. رابطه خطی معکوسی بینrCBF یاrCVB عادی و تغییر سیگنال درصد CVR عادی شده در ضایعات درجه چهار یافت شد. در ضایعات درجه سه یک جریان خطی کم شیب تر دیده شد که از اهمیت آماری کمی برخوردار بود، در حالی که هیچ رابطه ای در گروه درجه دو دیده نشد. تفاوت های آماری معناداری برای rflow وrvol در بین گروههای درجه دو و درجه چهار و بین گروههای درجه سه و درجه چهار و نه برای rCVR موجود بود. rCVR در هر گروه کمتر از یک بود. نتایج ما نشان داد که در حالی که طرح های پرفیوژن T₂MR و طرح های CVR برای ترسیم مناطق تومورال در معرض خطر NVU در گلوماهای با درجه بالا کافی هستند. طرح های CVR می توانند مناطقی که CVR در آنها کاهش یافته را در گلوماهای با درجه پایین و متوسط کشف کنندکه در آنهاNVU ممکن است با فاکتورهای دیگری به غیر از نئوواسکولاریزه توموری ایجاد شده باشد. مقایسه مناطقی که در آنها CVR به صورت غیر عادی کاهش یافته است با مناطق فاقد فعل سازی BOLD مبتنی بر وظیفه در نواحی قشری مورد انتظار که تومورها در آن نفوذ کرده اند یا مجاور تومور هستند 95% تطابق را آشکار کرد که این توانایی ترسیم BH CVR را برای نشان دادن مناطق NVU اثبات می کند.
مقدمه
مکانیسم جفت شدن شلیک نورونی و انبساط مغزی عروقی میتواند بهصورت معناداری در بیماریهای مغزی با یکدیگر تلاقی شود که این تشخیص مناطق قشری نزدیک یا درون ضایعات قابلبرداشت را با استفاده ازfMRI وابسته به سطح اکسیژن خون دچار مشکل میکند. چندین فاکتور متابولیک و عروقی برای توصیف این جداسازی عصبی_ عروقی به وجود آمده توسط ضایعه مدنظر قرارگرفتهاند، اما فعلاً هیچ استاندارد تصویربرداری برای کشف NVU وجود ندارد. درهرحال، در مطالعات ام آر آی بالینی BOLD این ضروری است که خطر NVUمورد ارزیابی قرار گیرد زیرا حضور NVUممکن است منجر به فعالسازی منفی کاذب شود. این فعالسازی منفی کاذب درfMRI BOLD پیش از جراحی ممکن است به برشهای فاجعه باری در کورتکس eloquent "خاموش" شود که اگر تائید الکتروفیزیولوژیک در حین عمل اجرا نشود قادر به تولید پاسخ BOLD نخواهد بود. درهرحال NVUممکن است اختلال در یک تعداد از اجزاء تشکیلدهنده یک آبشار پیچیده از نورونهای فعالشده تا انتقالدهندههای عصبی و استروسیت ها تا واسطهگرهای شیمیایی و نهایتاً عضله صاف دیواره رگها را شامل شود. هدف این مقاله، ما به موضوع بهعنوان آبشار جفت کننده عصبی _عروقی اشاره میکنیم. درحالیکه آشکار کردن NVU در سطوح نورونی، استروسیتی، انتقالدهنده عصبی یا واسطهگر شیمیایی توسط تصویربرداری MR بهتنهایی غیرممکن است این امکان وجود دارد که مرحله نهایی در این آبشار یعنی پاسخ مغزی_عروقی را ارزیابی کنیم. ازآنجاییکه هر چیزی که واکنشپذیری مغزی_عروقی را دچار اختلال کند، صرفنظر از تأثیر آن در امتداد آبشار، الزاماً منجر به NVU خواهد شد ما میتوانیم ترسیم CVR را بهعنوان یک نشانگر برای عامل بالقوه NVU در نظر بگیریم. T₂ Dynamic SusceptibilityContrast (DSC) تصویربرداری MR پرفیوژن گادولینیوم به نظر می رسد که بهطور غیرمستقیم خطر NVU را در گلوما های با درجه بالا ارزیابی کند که در آن حجم خون مغزی افزودهشده (rCVB) و جریان خون مغزی مرتبط (rCBF) با نئوواسکیولاریتی تومور مرتبط شدهاند که بهنوبه خود با CVR آسیبدیده که مسئول NVU است مرتبط میشود.درهرحال، مشخص نیست که نفوذ CVR معیوب درغده های مغزی با درجه پایین که در آنها هایپرپرفیوژن غیرمعمول است تا چه اندازه بالاست. هدف از این مطالعه نشان دادن این است که ترسیم BOLD CVR با استفاده از الگوی نگهداشتن تنفس یک شیوه عملی برای ارزیابی CVR در همه درجات تومور، شامل غدههای مغزی با درجات پایین و متوسط است که بهصورت نوعی با هایپرپرفیوژن منطقهای مرتبط نیستند و بنابراین ترسیم BOLD BH CVR ممکن است یک نشانگر عالی از خطر بالقوه NVU نسبت به تصویربرداری MR پرفیوژن باشد. این نشانگر تصویربرداری از عمل فعالسازی یا تحریک خنثی مستقل خواهد بود که ممکن است در آزمایشات fMRI بالینی بهکاربرده شود. علاوه بر این، BH CVR اجازه ارزیابی دینامیک CVR را خواهد داد، در حلی که ام آرآی پرفیوژن T2*DSC تنها به ارزیابی وضعیت ساکن پرفیوژن اجازه خواهد داد.با این وجود،علی رقم محدودیت های آن، تصویر برداری پرفیوژن T2*DSC MR در حال حاضر تنها رویکرد جایگزین موجود است که می تواند به آسانی درمحیط تصویر برداری MR بالینی برای ارزیابی حالت عروقی تومور مورد استفاده قرار گیرد. در این مطالعه، ما نتایج ترسیم BH CVR و متریک های پرفیوژن T2*DSC را در یک جمعیت درجه دو (درجه پایین)، درجه سه (آناپلاستیک) و درجه چهار (غده گلیایی) از تومورهای مغزی درون محوری اولیه را مورد مقایسه قرار دادیم تا میزان ارتباط این دو تکنیک را به عنوان نشانگر تصویر برداری برای پتانسیل NVU تعیین کنیم.
مواد و شیوه ها
شرکت کننده گان
نوزده بیمار که تومور مغزی آنها از نظر هیستوپاتولوژیکی به اثبات رسیده بود در این مطالعه که توسط Institutional Review Board مورد تایید قرار گرفته بود و مطابق با Health Insurance Portability and Accountability Act بود، قرار داشتند. دسته بندی تومور مطابق با راهبردهایی تعیین شد که توسط سازمان سلامت جهانی (WHO) فراهم شده بود. جدول 1 اطلاعات جمعیت شناسی شامل سن، موقعیت تومور و بافت شناسی هر بیماری را که در این مطالعه قرار داشت را گزارش می کند.
به دست آوردن تصویر
مطالعات بر روی یک سیستم Simens 3T Trio ( Siemens Medical Solution، Erlangen ، Germany) انجام شدند که با یک یک کویل ماتریس اصلی مجهز شده بود.
تصاویر BOLD با استفاده از یک دنباله Gradient_Echo EPI با وزن T2* تک ضربه ای کل مغز با پارامترهایی که در ادامه می آید به دست آمد: TR= 2000 ms ؛ TE = 30 ms؛ زاویه خطا 90 درجه؛ میدان دید 24cm ؛ کسب ماتریس 64×64 ؛ ضخامت تکه4mm با 1mm فاصله بین تکه ها. هر بیمار که در این تحقیق ثبت نام کرده بود یک باطری از بلوک زبان طراحی و فعالیت های حرکتی را در طی 3 تا 4 دقیقه اجرا کرد. زبان واقعی، فعالیت های حرکتی و تصویری در جدول 1 فهرست شده اند. عدد واقعی و نوع الگوها از یک بیمار تا بیمار دیگر بسته به موقعیت ضایعه و وضعیت عصبی بیمار متغییر بود. علاوه بر این آنها یک فعالیت BH را اجرا کردند که شامل چهار دوره متناوب از تنفس طبیعی و دوره BH بود. هر دوره تنفس نرمال 40 ثانیه ای با یک وقفه تنفس 4 ثانیه ای دنبال می شد که بلافاصله قبل از یک دوره BH 16 ثانیه ای بود. این به این منظور انجام می شد تا عملکرد پاسخ همودینامیک به دلیل کارBH اندزه گیری کند. یک تاخیر 10 تا 15 ثانیه ای بین کار و عملکرد پاسخ همودینامیک مورد انتظار در یک مطالعه اخیر توسط Brin و دیگران نشان داده شده است.
اشاره های شنیداری یا تصویری در طی الگوها مورد استفاده قرار گرفتند که به صورت تجاری در دسترس بوده یا در نرم افزار Prism acquire اجرا شدند.
بیماران از طریق یک مانیتور LCD در بیرون از اتاق اسکنر برای ارزیابی اجرای کارها مورد نظارت قرار گرفتند. یک جلسه آموزشی در بیرون از اسکنر اجرا شد تا بیماران را با وظایف آشنا کنند و این را ارزیابی کندکه آیا آنها قادر هستند دستور العمل ها را به درستی اجرا کنند، مخصوصا اینکه تنفس شان را برای مقدار زمان مورد نیاز نگه دارند. به آنها همچنین آموزش داده شد تا در طی مطالعه سرشان را کاملا ساکن و بدون حرکت نگه دارند. در هر حال، حرکت سر با استفاده از تسمه و بالشتک فومی به حداقل رسید. همه بیماران قادر بودند که با موفقیت وظایف شان را اجرا کنند.
MRI پرفیوژن تقابل حساسیت پویا، طی جلسه آزمایشی مشابه بعد از اینکه تصاویرfMRI به دست آمدند انجام شد. یک دنباله گرادیان اکو با وزن T2* و single-shot کل مغز برای تصویر برداری پرفیوژن مورد استفاده قرار گرفت تا تغییر سیگنال به خاطر تزریق bolus داخل وریدی ماده کنتراست زای مبتنی بر گادولینیوم را اندازه گیری کند. پارامترهای تصویر برداری عبارت بودند از:TR=2450ms ؛ TE=45ms ؛ زاویه خطا 90 درجه؛ میدان دید24 cm ؛ به دست آوردن ماتریس 128×128 ؛ ضخامت تکه 4mm با 1mm فاصله. 32 حجم دور نداخته شدند تا به سیگنال MR اجازه دهند تا به یک وضعیت ثابت برسد.
تصاویر3D اکو گرادیان تحصیل سریع آماده شده از طریق مغناطیسی کردن با وزن T1 قبل و بعد از کنتراست به دست آمدند. پارامترهای تصویر برداری عبارت بودند از:TR=7ms ؛ TE=3.5ms ؛ زاویه خطا 9 درجه؛ میدان دید 24cm؛ به دست آوردن ماتریس 256×256 ؛ ضخامت تکه 1mm .دنباله تصویر برداری وزنی حساسیت نیز با پارامترهای که در ادمه می آید انجام شد: TR=27ms، TE= 20ms ، زاویه خطا 15درجه، میدان دید 24cm ، تحصیل ماتریس 256×256، ضخامت تکهmm 1.5 .
The coupling mechanism between neuronal firing and cerebrovascular dilatation can be significantly compromised in cerebral diseases, making it difficult to identify eloquent cortical areas near or within resectable lesions by using Blood Oxygen Level Dependent (BOLD) fMRI. Several metabolic and vascular factors have been considered to account for this lesioninduced neurovascular uncoupling (NVU), but no imaging gold standard exists currently for the detection of NVU. However, it is critical in clinical fMRI studies to evaluate the risk of NVU because the presence of NVU may result in false negative activation that may result in inadvertent resection of eloquent cortex, resulting in permanent postoperative neurologic deficits. Although NVU results from a disruption of one or more components of a complex cellular and chemical neurovascular coupling cascade (NCC) MR imaging is only able to evaluate the final step in this NCC involving the ultimate cerebrovascular response. Since anything that impairs cerebrovascular reactivity (CVR) will necessarily result in NVU, regardless of its effect more proximally along the NCC, we can consider mapping of CVR as a surrogate marker of NVU potential. We hypothesized that BOLD breath-hold (BH) CVR mapping can serve as a better marker of NVU potential than T2* Dynamic Susceptibility Contrast gadolinium perfusion MR imaging, because the latter is known to only reflect NVU risk associated with high grade gliomas by determining elevated relative cerebral blood volume (rCBV) and relative cerebral blood flow (rCBF) related to tumor angiogenesis. However, since low and intermediate grade gliomas are not associated with such tumoral hyperperfusion, BOLD BH CVR mapping may be able to detect such NVU potential even in lower grade gliomas without angiogenesis, which is the hallmark of glioblastomas. However, it is also known that glioblastomas are associated with variable NVU, since angiogenesis may not always result in NVU. Perfusion metrics obtained by T2* gadolinium perfusion MR imaging were compared to BOLD percentage signal change on BH CVR maps in a group of 19 patients with intracranial brain tumors of different nature and grade. Single pixel maximum rCBV and rCBF within holotumoral regions of interest (i.e., “ipsilesional” ROIs) were normalized to contralateral hemispheric homologous (i.e., “contralesional”) normal tissue. Furthermore, percentage signal change on BH CVR maps within ipsilesional ROIs were normalized to the percentage signal change within contralesional homologous ROIs. Inverse linear correlation was found between normalized rCBF (rflow) or rCBV (rvol) and normalized CVR percentage signal change (rCVR) in grade IV lesions. In the grade III lesions a less steep inverse linear trend was seen that did not reach statistical significance, whereas no correlation at all was seen in the grade II group. Statistically significant difference was present for rflow and rvol between the grade II and IV groups and between the grade III and IV groups but not for rCVR. The rCVR was significantly lower than 1 in every group. Our results demonstrate that while T2*MR perfusion maps and CVR maps are both adequate to map tumoral regions at risk of NVU in high grade gliomas, CVR maps can detect areas of decreased CVR also in low and intermediate grade gliomas where NVU may be caused by factors other than tumor neovascularity alone. Comparison of areas of abnormally decreased regional CVR with areas of absent BOLD task-based activation in expected eloquent cortical regions infiltrated by or adjacent to the tumors revealed overall 95% concordance, thus confirming the capability of BH CVR mapping to effectively demonstrate areas of NVU.
Introduction
The coupling mechanism between neuronal firing and cerebrovascular dilatation can be significantly compromised in cerebral diseases, making it difficult to identify eloquent cortical areas near or within resectable lesions by using Blood Oxygen Level Dependent (BOLD) fMRI (1). Several metabolic and vascular factors have been considered to account for this lesion-induced neurovascular uncoupling (NVU), but no imaging gold standard exists currently for the detection of NVU (2). However, it is critical in clinical BOLD fMRI studies to evaluate the risk of NVU because the presence of NVU may result in false negative activation. Such false negative activation in presurgical BOLD fMRI may lead to catastrophic resection of apparently “silent” eloquent cortex, which is incapable of producing a BOLD response, if intraoperative electrophysiological confirmation is not performed. However, NVU may involve disruption of any of a number of components comprising a complex cascade from activated neurons to neurotransmitters to astrocytes to chemical mediators and finally vascular smooth muscle (17). For purposes of this paper, we will refer to this as the neurovascular coupling cascade. While it is impossible to detect NVU at the neuronal, astrocytic, neurotransmitter or chemical mediator levels by MR imaging alone, it is possible to evaluate the final step in this cascade: the cerebrovascular response. Since anything that impairs cerebrovascular reactivity (CVR) will necessarily result in NVU, regardless of its effect more proximally along the cascade, we can consider mapping of CVR as a surrogate marker of NVU potential. T2* Dynamic Susceptibility Contrast (DSC) gadolinium perfusion MR imaging seems to indirectly evaluate NVU risk in high grade gliomas (4), where elevated relative cerebral blood volume (rCBV) and relative cerebral blood flow (rCBF) have been associated with tumor neovascularity, which in turn is associated with impaired CVR that is responsible for NVU. However, it is not clear how high the prevalence of impaired CVR (and resultant NVU) is in low grade gliomas, in which hyperperfusion is unusual. The goal of this study is to demonstrate that BOLD CVR mapping using a breath hold (BH) paradigm is a feasible method of evaluating CVR in all tumor grades, including in low and intermediate grade gliomas that are not typically associated with regional hyperperfusion, and as such, BOLD BH CVR mapping may serve as a superior marker of NVU potential than MR perfusion imaging. This imaging marker would be independent of the activation task or neural stimulus that may be applied in clinical fMRI examinations. In addition, BH CVR allows dynamic evaluation of CVR, whereas T2*DSC perfusion MRI only allows for resting state evaluation of perfusion. Nevertheless, in spite of its limitations, T2*DSC MR perfusion imaging is the only currently available alternative approach that can be readily used in the clinical MR imaging setting to assess tumor vascularity. In this study, we compared BH CVR mapping results and T2*DSC perfusion metrics in a population of grade II (low grade), III (anaplastic) and IV (glioblastoma) primary intra-axial brain tumors (gliomas), to assess the relative value of these two techniques as imaging markers of NVU potential.
Materials and Methods
Participants
Nineteen patients with histopathologically proved brain tumors were included in this retrospective study that was approved by our Institutional Review Board and was compliant with the Health Insurance Portability and Accountability Act. Tumor classification was determined according to the guidelines provided by the World Health Organization (WHO) (5). Table I reports demographic data including age, tumor location and histology for each patient included in the study.
Image Acquisition
Studies were performed on a Siemens 3T Trio system (Siemens Medical Solution, Erlangen, Germany) equipped with a head matrix coil.
BOLD images were acquired by a whole brain single-shot T2*-weighted Gradient-Echo EPI sequence with the following parameters: TR 5 2000ms; TE 5 30ms; 908 flip angle; 24 cm field of view; 64 3 64 matrix acquisition; slice thickness 4mm with 1mm gap between slices. Each patient recruited in the study performed a battery of block design language and motor tasks, 3 or 4 minutes long. The actual language, motor and visual tasks are listed in Table I. The actual number and type of paradigms varied from patient to patient depending on the location of the lesion and the patients neurological conditions. In addition they performed also a BH task that included four cycles of alternating normal breathing and BH periods. Each normal breathing period of 40 seconds duration was followed by a 4 second block of inspiration that immediately preceded a 16-second BH period. At the end of the last BH period an additional normal breathing period of 20 seconds was added. This was done in order to measure more accurately the hemodynamic response function due to the BH task. A 10-15 sec delay between the task and the expected hemodynamic response function has indeed been demonstrated in a recent work by Birn and others (6).
Visual or auditory cues were used during the paradigms, that were commercially available or implemented in Prism Acquire Software (Prism Clinical Imaging, Elm Grove, WI, USA).
Patients were monitored via a LCD monitor outside the scanner room to assess tasks performance. A training session was performed outside the scanner in order to familiarize the patients with the tasks and to assess whether they were able to properly follow the instructions, particularly to hold their breath for the required amount of time. They were also instructed to keep their head absolutely still without motion throughout the entire study. However, head motion was minimized by using straps and foam paddings. All the patients were able to successfully perform the tasks.
Dynamic Susceptibility Contrast perfusion MRI was carried out within the same examination session after BOLD fMRI images were acquired. A whole brain single-shot T2*-weighted Gradient-Echo EPI sequence was used for perfusion imaging to measure signal change due to intravenous bolus injection of a Gadolinium-based contrast agent (Magnevist, concentration 0.1mmol/kg). Imaging parameters were the following: TR 5 2450ms; TE 5 45ms; 908 flip angle; 24cm field of view; 128 3 128 matrix acquisition; slice thickness 4mm with 1mm interslice gap. 32 volumes were acquired and the first two were discarded to allow the MR signal to reach steady state.
Pre and post contrast 3D T1-weighted Magnetization Prepared Rapid Acquisition Gradient Echo (MPRAGE) images were acquired. Imaging parameters were: TR 5 7ms; TE 5 3.5ms; 98 flip angle; 24cm field of view; 256 3 256 matrix acquisition; slice thickness 1mm. A susceptibility weighted imaging (SWI) sequence was also carried out with the following parameters: TR 5 27ms, TE 5 20ms, 158 flip angle, 24cm field of view, 256 3 256 matrix acquisition, slice thickness 1.5mm.
مقدمه
مواد و شیوه ها
شرکت کننده گان
به دست آوردن تصویر
پردازش تصویر
متدهای آماری
نتایج
بحث ها
منابع
Introduction
Materials and Methods
Participants
Image Acquisition
Image Processing
Statistical Methods
Results
Discussion
References
