
دانلود رایگان مقاله توارث چند نسلی و انتقال بین نسل ها در مواجهه با مواد مخدر
چکیده
توارث فامیلی از سوء مصرف مواد از فاکتورهای ژنتیکی و محیطی ساخته شده است. به علاوه، توارث بین نسلی اپی ژنتیکی ممکن است ابزارهایی را فراهم کند که توسط آن استفاده از مواد توسط والدین میتواند نسل های مختلفی از زادههارا تحت تاثیر قرار دهد. شواهد اخیر پیشنهاد میکند که مواجهه والدین با داروها تغییرات رفتاری، بیوشیمیایی و آناتومیعصبی را در نسل های بعدی ایجاد میکند. تمرکز این مطالعه بر این است که درباره این فنوتیپ های بین نسلی و چند نسلی در زاده های جانورانی بحث کند که در معرض سوء مصرف مواد بوده اند. به طور ویژه، تغییرات ناشی از مصرف الکل، افیون، کوکائین، ماری جوانا و نیکوتین مورد بحث قرار میگیرند. به علاوه، تغییرات اپی ژنتیکی ژنوم در نتیجه مصرف این داروها با جزئیات بحث میشوند. هم چنین پتانسیل آنهابرای انتقال به نسل بعد مورد بررسی قرار میگیرند.
1. مقدمه
مصرف مواد بر نواحی قشری مغز تاثیر میگذارد و منجر به تاثیر در سیستم پاداش دهی و اشتیاق، وابستگی دارویی، صرف نظر کردن از آن و جایگزینی در هر دو بخش اضطراب و حافظه یادگیری میشود. یافته های کلینیکی الگوهای خانوادگی از مصرف مواد و وابستگی به آن را ثبت کرده اند. مطالعات مربوط به ژنوم گسترده(GWAS) تعدادی از ژن ها، نواحی کروموزومیو واریته های اللی را معرفی کرده اند که مربوط به اعتیاد به مواد هستند. اگرچه همه اطلاعات توارثی در توالی DNA وجود ندارد. اخیرا جایگزینی های شیمیایی در ژنوم که مرتبط با تنوع در توالی DNA نیست در ژنوم یاقت شده اند که مربوط به مواجهه با مواد است و این تغییرات اپی ژنتیکی ممکن است مربوط به سوء مصرف مواد باشند و وابستگی بین نسل های فامیلی را نشان دهند. به طور ویژه، توالی های فنوتپیی مختلف از مواجهه دارویی در نسل های مختلف زادههاشناسایی شده اند که مخالف مواجهه قبلی با مواد بوده اند و هیچ تنوع کروموزومییا اللی را ایجاد نکرده اند. بنابراین، تغییرات اپی ژنتیکی میتواند مکانیسمیرا فراهم کند که در آن پایداری شرایط دارویی مثل سوء مصرف مواد در هر دو نسل و در بین نسلهاوجود داشته باشد.
تمرکز این مطالعه بر این است که درباره تنوع های فنوتیپی (رفتار، شیمیعصب و ساختار) در زاده هایی بحث کند که والدین و اجداد آنهادر مدل های حیوانی در مواجهه با مواد بوده اند. توارث تغییرات رفتاری میتواند به دستاوردهایی ختم شود که پاسخ مواد را اندازه گیری میکنند و حساسیت حیوانات به مواد را میسنجند. به علاوه، تغییرات اپی ژنتیکی تنظیم ژن در پاسخ یا بررسی اثرات سوء مصرف مواد بحث خواهند شد. در نهایت، انتقال تغییرات اپی ژنتیکی از طریق سلول های زایشی به عنوان مکانیسمیکه ممکن است توارث بین نسلهارا رقم بزند مرور خواهد شد.
2. اپی ژنتیک
در تلاش برای تعیین تفاوت های وسیع با استفاده از اصطلاح اپی ژنتیک، Adrian Bird یک تعریف را مطرح کرد که در آن هم مکانیسم های شیمیایی هم برای توارث الزامیبودند. اپی ژنتیک سازگاری ساختاری نواحی کروموزومیاست که میتوانند حالت های فعالیت جایگزین شده تعیین شده یا منفردی را ایجاد کنند. بنابراین، این تغییرات کروموزومیمیتواند ناگهانی باشد یا در طی زمان برای پاسخ به مواجهه با یک محرک ایجاد شود. اگرچه در غیاب سیگنال یا رخدادی که این تغییر را ایجاد کرده است، هم میتواند به ارث برسد. به علاوه، جایگزینی های شیمیایی ژنوم مربوط به اپی ژنوم است زمانی که در مرحله بسته بندی DNA اتفاق میافتد که میتواند تغییرات در عملکرد بیان ژنهاهم ایجاد کند. توارث اپی ژنتیکی با پایداری تغییراتی اتفاق میافتد که در نسل های مختلفی از تقسیم سلولی یا نسل های مختلف حیوانات به دست آمده اند. تغییرات اپی ژنتیکی سلولی در پاسخ به محیط شامل بازآرایی کروماتین و متیلاسیون DNA است. توضیح بیشتر از این تغییرات در کادر ۱ آورده شده است.
کادر ۱. تغییرات اپی ژنتیکی
-بازآرایی کروماتین و تغییرات هیستونی
کمپلکس های هیستونی دارای یک دم انتهایی آمینو(N) هستند که میتواند متحمل تغییرات شود. این تغییرات حالت DNA پیچیده شده در اطراف هیستون را متراکم تر یا رهاتر میکند. تغییرات شامل استیلاسیون، متیلاسیون، فسفریلاسیون، یوبی کوئیلاسیون، SUMOlyation است. اگرچه برای هدف این مطالعه، فقط استیلاسیون و متیلاسیون مورد بحث قرار میگیرند.
-استیلاسیون
استیلاسیون دم هیستونی کروماتین را رها میکند و به ژنهااجازه بیان شدن میدهد. به عنوان مثال، استیلاسیون هیستون ۳(AcH3) و استیلاسیون لیزین ۱۵ از هیستون ۳(aceH3K14) هر دو مرتبط با رونویسی افزایش یافته از ژن های هدف هستند.
-متیلاسیون
متیلاسیون هیستونهامیتواند باعث فعال شدن ژن یا مهار آنهاشود که این امر وابسته به رزیدویی است که این تغییر را متحمل میشود. تری متیلاسیون هیستون ۳ لیزین ۴ (H3K4me3) سبب فعال شدن بیان ژن میشود در حالی که دی متیلاسیون هیستون ۳ لیزین ۹(H3K9me2) مرتبط با یک ژن، موجب سرکوب ژن میشود. برای مرور کامل مکانیسم توارث اپی ژنتیکی و تئوری های مربوط به آن برای انتقال تغییرات هیستونی از طریق تقسیم DNA به مقاله زیر مراجعه کنید. Martin and Zhang 2007))
-متیلاسیون DNA
متیلاسیون DNA نسخه برداری را با فعال کردن مستقیم ژنوم تنظیم میکند. در تحقیقات قبلی پیشنهاد شده است که حضور گروه های متیل، بیان ژن را سرکوب میکند اگرچه این موضوع همیشه اتفاق نمیافتد. DNA متیل ترانسفرازها(DNMTs) اضافه شدن گروه متیل را به نوکلئوتید سیتوزین کاتالیز میکنند که معمولا در کنار نوکلئوتید گوانین قرار دارد(CpG). گروه های متیل توسط S- آدنوزین متیونین(SAM) فراهم میشوند. بنابراین اضافه شدن متیل به سیتوزین، سیتوزین را به 5- متیل سیتوزین تبدیل میکند. تنظیم ژن از طریق متیلاسیون DNA از طریق CpGهادر نواحی تنظیمیژن ها(پروموترها، افزایندههاو عایق ها) فراهم میشود.
شواهدی وجود دارد که بیان گروهی از RNA های کوچک غیر کد کننده که به نام miRNA شناخته میشوند، میتوانند فنوتیپ را به نسل بعدی منتقل کنند. از آن جایی که miRNAهادر حضور استرس بیان میشوند، شواهدی وجود ندارند که اثرات مربوط به miRNA را در مواجهه با مواد در زادههانشان دهد. نسبتا پیچیده است که مکانیسمیبرای توارث تعیین شود که بتواند رفتارهای جایگزین، پاسخ های بیوشیمیایی و مورفولوژی سلولی را در زاده هایی توضیح دهد که والدین F0 آنهادر معرض قرار گرفته بوده اند. بنابراین، هر تغییرات اپی ژنتیکی در رده مواد در بدن حیوانات ر معرض مورد توجه قرار میگیرد هم چنین شواهدی برای توارث نسلی تغییرات شیمیایی در ژنوم بررسی میشود.
3. اپی ژنتیک در طی نسل ها
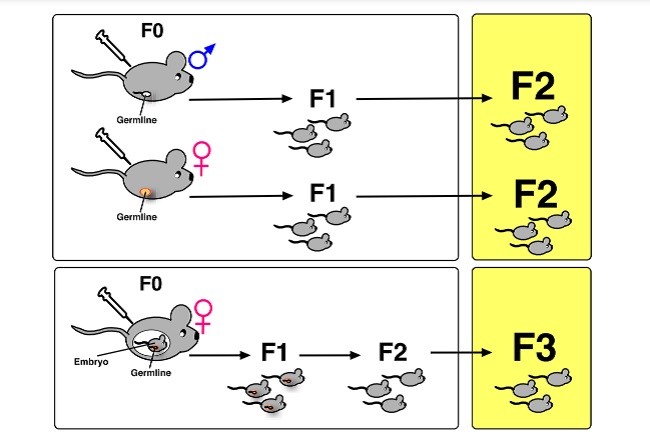
توارث بین ژنی اپی ژنتیکی به عنوان توارث وابسته به سلول های زایشی از اطلاعات اپی ژنتیکی بین نسلهاتعریف میشود که در غیاب تاثیرات محیطی مستقیم اتفاق میافتد که منجر به تنوع فنوتیپی میشود. در عوض، فنوتیپ های چند نسلی از مواجهه مستقیم با مواد به وجود میآیند. بنابراین، اگر مواجهه با مواد در مردها یا زن های نسل F0 قبل از بارداری صورت بگیرد، سلول های زایشی که قرار است نسلF1 را بسازند هم در معرض قرار میگیرند. بنابراین، فنوتیپ های موجود در حیوانات F0 و F1 چند نسلی هستند و آن هایی که فقط در حیوانات F2 دیده میشوند به عنوان بین نسلی از حیوانات F2 و نسل اول شناخته میشوند که سلول هایی هستند که در معرض دارو قرار نمیگیرند.(شکل۱، بالا).
abstract
Familial inheritance of drug abuse is composed of both genetic and environmental factors. Additionally, epigenetic transgenerational inheritance may provide a means by which parental drug use can influence several generations of offspring. Recent evidence suggests that parental drug exposure produces behavioral, biochemical, and neuroanatomical changes in future generations. The focus of this review is to discuss these multigenerational and transgenerational phenotypes in the offspring of animals exposed to drugs of abuse. Specifically, changes found following the administration of alcohol, opioids, cocaine, marijuana, and nicotine will be discussed. In addition, epigenetic modifications to the genome following administration of these drugs will be detailed as well as their potential for transmission to the next generation.
1. Introduction
Drug abuse impacts critical brain regions resulting in rewardseeking and craving, drug dependence, withdrawal, and alterations in both anxiety and learning and memory (Koob and Volkow, 2009). Clinical findings document familial patterns of drug use and dependence (Nielsen et al., 2012). Genome-wide association studies (GWAS) have identified a number of genes, chromosomal regions, and allelic variants likely to contribute to drug addiction, however not all inherited information is present in DNA sequence. Recently chemical alterations in the genome not related to DNA sequence variations have been identified following drug exposure and these epigenetic modifications may contribute to drug abuse and dependence across familial generations (Hughes, 2014). Specifically, several phenotypic consequences of drug exposure are found across multiple generations of offspring, despite no previous exposure to drug and no allelic or chromosomal variation (Skinner, 2008). Thus, epigenetic modifications could provide a mechanism underlying the longevity of psychiatric conditions such as drug abuse both within, as well as across generations (Nielsen et al., 2012).
The focus of this review is to discuss phenotypic variation (behavior, neurochemical, and structural) in offspring of drugexposed parents and grandparents in animal models. Inheritance of behavioral changes will be limited to outcomes that measure drug response and reward sensitivity in animals. In addition, epigenetic modifications of gene regulation in response to or mediating the effects of drugs of abuse will be discussed. Finally, the transmission of epigenetic changes through the germ line as a mechanism that may underlie transgenerational inheritance will be reviewed.
2. Epigenetics
In an attempt to rectify the vast differences in use of the term epigenetics, Adrian Bird proposed a definition that encompasses both the chemical mechanisms as well as the necessity for inheritance: epigenetics is “the structural adaptation of chromosomal regions so as to register, signal or perpetuate altered activity states” (Bird, 2007). Therefore, these chromosomal modifications can be sudden or accumulate over time in response to exposure to a stimulus and is, nevertheless, inherited in the absence of the signal or event that initiated the change (Bird, 2007). In addition, chemical alterations to the genome, also referred to as the epigenome when including the DNA packaging, can ultimately change the functional expression of genes (Bird, 2002). Epigenetic inheritance occurs by persistence of the modifications through several generations of cell division or animals (Bird, 2007).Cellular epigenetic modifications in response to the environment include chromatin remodeling and DNA methylation (Skinner, 2011; Daxinger and Whitelaw, 2012). Further explanation of these modifications can be found in Box 1. There is some evidence that expression of a class of small noncoding RNAs known as micro RNAs (miRNAs) can transmit phenotypes to the next generation (Rassoulzadegan et al., 2006). While miRNAs have been implicated in the inheritance of stress (Gapp et al., 2014; Rodgers
Box 1 Epigenetic Modifications.
Chromatin Remodeling and Histone Modifications
Histone complexes contain an amino (N) terminal tail that can undergo modifications; these modifications “condense” or “relax” the state of DNA wrapped around the histone. Modifications include acetylation, methylation, phosphorylation, ubiquitylation, and SUMOylation, however for the purposes of this review only acetylation and methylation will be discussed.
Acetylation
Acetylation of histone tail relaxes chromatin and allows for gene transcription. For example acetylation of histone 3 (AcH3) and acetylation of lysine 14 of histone 3 (aceH3K14) are both correlated to increased transcription of target genes.
Methylation
Histone methylation can cause gene activation or repression depending on the residue undergoing modification. Histone 3 lysine 4 trimethylation (H3K4me3) causes the activation of gene transcription while histone 3 lysine 9 dimethylation (H3K9me2) association with a gene is correlated to repression of that gene. For a thorough review on epigenetic inheritance mechanisms and specifically theories on histone modification transmission through DNA replication see (Martin and Zhang, 2007).
DNA methylation
DNA methylation regulates transcription by acting directly on the genome. In the past research has suggested that the presence of methyl groups suppresses gene expression, however this is not always the case.DNA methyltransferases (DNMTs) catalyze the addition of a methyl group onto a cytosine nucleotide that is usually positioned next to a guanine nucleotide (CpG). Methyl groups are donated by S-adenosyl methionine (SAM); therefore, the addition of a methyl onto the cytosine converts the cytosine to 5-methylcytosine. Gene regulation via DNA methylation is achieved through CpGs in the regulatory regions (promoters, enhancers, insulator) of genes.
there is no evidence to suggest miRNA mediated effects of drug exposure on offspring. It is quite complex to establish a mechanism of inheritance that could account for altered behaviors, biochemical responses, and cellular morphology in the offspring of F0 exposed parents. Therefore, within each drug class epigenetic changes of interest within the animal exposed will be discussed as well as any evidence of generational inheritance of chemical modifications to the genome.
3. Epigenetics across generations
Epigenetic transgenerational inheritance is defined as “germline-mediated inheritance of epigenetic information between generations in the absence of direct environmental influences that leads to phenotypic variation” (Skinner, 2011). In contrast, multigenerational phenotypes are those derived from direct exposure to the drug. Thus, if drug exposure occurs in F0 males or females prior to pregnancy, the germ cells, which go on to produce the F1 generation are also “exposed”. Therefore, phenotypes found in F0 and F1 animals are multigenerational and only those present in F2 animals are considered transgenerational as these F2 animals are the first generation whose cells have not been exposed to drug (Fig. 1, top).
چکیده
1. مقدمه.
2. اپی ژنتیک
3. اپی ژنتیک در طی نسل ها
4. تکامل گامت و برنامه ریزی دوباره
5. توارث مواجهه با مواد
۵.۱. الکل
۵.۲. افیون ها
۵.۳. کوکائین
۵.۴. ماری جوانا
۵.۵. نیکوتین
6. نتیجه گیری و چشم انداز
1. Introduction
2. Epigenetics
3. Epigenetics across generations
4. Gamete development and reprogramming
5. Inheritance of drug exposure
5.1. Alcohol
5.2. Opioids
5.3. Cocaine
5.4. Marijuana
5.5. Nicotine
6. Conclusion and Perspectives
Acknowledgments
References
