
دانلود رایگان مقاله دخالت microRNA در جنبه های کاربردی و تکاملی سیستم عصبی
چکیده
microRNA، RNAهای کوچک غیر کد کننده ای هستند که بیان ژن را در سطح پس از ترجمه تنظیم میکنند و برای تنظیم مولکولی ضروری به نظر میرسند که در بیان ژنهای تعدیل کننده در طی تکامل عصبی و عملکرد آن دخالت دارند. microRNAها نقشی را در طی هماهنگی سلولهای بنیادی عصبی و تمایز اولیه ایفا میکنند و هم مراحل پایانی تکامل عصبی را شامل میشوند مثل تشکیل دندریتها و ارتجاع پذیری سیناپسی. یک ارتباط بین microRNAها و بیماریهای عصبی مثل تخریب عصبی یا اختلال در عملکرد سیناپسی، با پیشرفت قابل ملاحظه ای در حال آشکار شدن است. این مقاله مروری، یافتههای اخیر را درباره عملکرد microRNAها در تکامل و سیستم عصبی بالغ و پتانسیلهای قابل ملاحظه آنها در ارتباط با بیماریهای عصبی خلاصه شده است.
مقدمه
کشف microRNAها(miRNAs)یک لایه جدید برای تنظیم کنترل بیان ژن را معرفی کرده است. miRNAها، RNAهای غیر کد کننده کوتاهی هستند که در حدود ۲۱ نوکلئوتید طول دارند که بیان ژن را در سطح پس از ترجمه و با هدایت ماشین مولکولی به ناحیه غیر ترجمه شونده 3′-UTR از mRNA اختصاصی تنظیم میکنند تا بیان آنها را کنترل کند. از آن جایی بیوژنز و مکانیسم عمل miRNAها به طور گسترده در سایر مقالات بیان شده است، این مقاله فقط به طور خلاصه مروری را مطرح میکند. بسیاری از miRNAها توسط پلیمرازII بیان میشوند، در حالی که تعداد کمیاز miRNAهای انسانی هم نشان داده شده است که توسط پلیمراز III رونویسی میشوند. رونوشت اولیه(pri-miRNA) میتواند بیشتر از هزار نوکلئوتید طول داشته باشد و دارای ساختارهای سنجاق سری باشد. درون هسته، pri-miRNA توسط آنزیم RNaseIII به نام Drosha دست ورزی میشود و منجر به یک پیش ساز سنجاق سری با طول ۷۰ نوکلئوتید میشود که دارای آویزهای ۲ نوکلئوتیدی در بخش 3′ است. این آویز به وسیله اکسپورتین -۵ شناخته میشود که miRNA را به درون سیتوپلاسم منتقل میکند. در سیتوپلاسم، pre-miRNA بعدا توسط آنزیم RNaseIII Dicer برش داده میشود. این منجر به تشکیلmiRNA duplex :miRNA حدواسطی میشود که دارای miRN بالغ ۲۱ نوکلئوتیدی و جایگاه ستاره ای آن miRNA⃰ است. با ادامه باز شدن پیچ و تاب miRNA دورشته ای با یک هلیکاز، miRNA بالغ به درون کمپلکس خاموش کننده القایی RNA(RISC) وارد میشود در حالی که miRNA⃰ معمولا تجزیه میشود. اتصال miRNA به mRNA هدف نیاز به RISC و حضور پروتئینهای Argonaute(Ago) دارد. تشخیص miRNA هدف معمولا دارای جفت شدن بازی بین باقی ماندههای ۲-۸ در انتهای 5′ miRNA میباشد که توالی دانه نامیده میشود و توالی مکمل آن در 3′-UTR از mRNA هدف وجود دارد. بسته به درجه مکمل بودن میان miRNAو هدفش، mRNA هدف میتواند شکسته شود و تجزیه شود یا به صورت ترجمه شونده ای مهار شود. مکمل بودن کامل تخریب mRNA را القا میکند در حالی که مکمل بودن ناقص منجر به مهار ترجمه میشود. در حیوانات، miRNA خاموش کننده بیان ژن به صورت قابل ملاحظه ای با مهار ترجمه کنترل میشود. تاکنون، مکانیسمهای پشت مهار ترجمه شناخته شده اند. تنظیم در مرحله آغاز ترجمه، به عنوان یکی از مکانیسمهای اصلی برای مهار ترجمه شناخته شده است اگرچه شواهدی برای تنظیم مراحل پس از آغاز هم تاکنون مورد نظر قرار گرفته اند. miRNAهای القا کننده مهار ترجمه به نظر میرسد که در مثالهای اندکی میتوانند برگشت پذیر باشند، نشان میدهد که miRNA، دینامیک تنظیمیو پاسخ به نیازهای سلولی خاص را کنترل میکند.
ژنهای miRNA مهره داران هم چنین در ژنهای جداشده یا خوشههای miRNA بزرگ که در ژن واقع شده اند هم میتواند اتفاق بیفتد که به صورت متعاون به صورت رونوشتهای اولیه پلی سیسترنی ترجمه میشوند. ژنهای miRNA بدون خوشه میتوانند از پروموترهای خودشان ترجمه شوند در حالی که به ترتیب 40% و 10% از ژنهای miRNA انسانی و موشی درون اینترونها و اگزونها واقع شده اند. که رونوشتهای کد کننده پروتئین و غیر پروتئینی هستند که در طی ژنهای میزبان بیان میشوند.
miRNAها در موجودات پرسلولی بسیار رایج هستند و بر بیان بسیاری از ژنهای کد کننده پروتئین تاثیر میگذارند. تاکنون، حدود 700 miRNA در ژنوم انسانی توصیف شده اند و تعداد آنها به طور پیوسته در حال افزایش است. تخمین زده میشود که هر miRNA برای بیشتر از ژن هدف میتواند تاثیر بگذارد و در کنار هم پیشنهاد میشود که miRNA میتوانددر حدود یک سوم از ژنهای کد کننده پروتئین در حیوانات را به عنوان هدف قرار دهد و حدود 60% از توالیهای حفاظت شده بین miRNAهای بالغ انسانی و موش مشاهده شده است. miRNAها در فرآیندهای سلولی مختلفی تاثیر دارند مثل زمان بندی تکامل، آپوپتوز، متابولیسم، میوژنز و کاردیوژنز (تشکیل بافتهای قلبی).
با در نظر گرفتن پیچیدگی بالایی از مغز و سیستم عصبی آن، اصلا شگفت انگیز نیست که miRNAها به عنوان تنظیم کنندههای ضروری تکامل و عملکرد سیستم عصبی در نظر گرفته شوند. تحقیقات بر روی miRNA هم چنان یک حوزه جدید محسوب میشود و مکانیسمهای جزئی دخالت miRNA در سیستمهای تنظیم کننده سیستمهای عصبی هنوز در ابتدای راه هستند و به طور کامل شناخته نشده اند. این مقاله مروری یافتههای اخیر درباره دخالت مسیرهای تنظیمیmiRNA در عملکرد سیستمهای عصبی در حال تکامل و در حال توسعه و هم چنین در بیماریهای عصبی را مورد بررسی قرار داده است.
نقش Dicer و miRNA در سیستم عصبی
مغز منبعی غنی از miRNA است و مطالعات مختلفی با استفاده از پروفایل بیانی miRNA نشان داده است که جزء اصلی miRNAها غنی میشوند یا به طور اختصاصی در سیستمهای عصبی بیان میشوند و بیان آنها به صورت دقیقی در طی تکامل مغز تنظیم میشود. این امر در ابتدا، نقش مهم miRNA را در تکامل مغز، افتراق نورونی و تنظیم مغز و بیان ژنهای اختصاصی نورونها را نشان میدهد. حذف Dicer ژنومیمنجر به حذف همه miRNAهای بالغ میشود و به عنوان یک ابزار ارزشمند برای مطالعه دخالت کلی مسیرهای تنظیمیmiRNA در سیستم عصبی معرفی میشود. نقایص مورفوژنز شدید مغز در موتانتهای دارای dicer خاموش شده در zebrafishمشاهده شده است. فقدان Dicer میتواند توسط miR-430 انجام شود که از خانواده بزرگ miRNA در طی تکامل اولیه zebrafish بیان میشود و نقشی اساسی را برای این خانواده miRNA در طی تکامل مغزی ایفا میکند. در موشها، حذف Dicer سبب تخریب نورونها و مرگ سلولی در زیرجمعیتهای نورونی میشود مثل نورونهای دوپامین در مغز، سلولهای پورکینج پس از میتوز در مخچه و نورونهای پیش قشری. به علاوه، فقدان Dicer در قشر و هیپوکاموس بر موروفولوژی بافت و سلول، مسیرهای ردیابی آکسونی و آپوپتوز تاثیر میگذارد. این امر نشان میدهد که miRNAها در چنین فرآیندهای متنوعی دخیل هستند مثل مورفوژنز نورونی و بافتی، زنده ماندن نورونی و احتمالا بیماریهای تخریب نورونی. خاموش کردن Dicer در پیش سازهای قشر عصبی، بر افتراق عصبی تاثیر میگذارند و منجر به تمایز نهایی غیر عادی در پیش سازهای بویایی در حال تکامل میشود. مهار خانواده miR-200 به تنهایی، یک خانواده miRNA است که به میزان بالایی در بافتهای بویایی بیان میشود، فنوکپیهای افتراقی انتهایی در پیش سازهای بویایی را دچار نقص میکند. در کل، این نتایج منجر به نقش کلیدی برای miRNAها در طی تمایز عصبی میشود.
مطالعات با استفاده از موتانتهای Dicer بدون شک نقشی را برای miRNAها در بسیاری از جنبههای سیستم عصبی نشان میدهند. به علاوه، حذف Dicer هیچ عملکردی از miRNAهای منفرد را نشان نمیدهد. بقیه این مقاله مروری بر تاثیر miRNAهای منفرد بر جنبههای تکاملی و کاربردی سیستم عصبی میپردازد.
miRNAها در اختصاصیت ردههای سلول عصبی و تمایز آنها
مطالعاتی انجام شده است که اهمیت miRNA را در مسیرهای تنظیمیدر رخدادهای اولیه تکاملی نشان میدهد مثل ارتباط سلولهای بنیادی عصبی، تمایز و رشد خارجی نورونی. Let5-7 در سینورابتیدیس الگانس به عنوان یک تنظیم کننده زمان بندی تکامل از طریق تنظیم تکثیر سلولی و تمایز شناسایی شده است. این miRNAها در بافتهای مغز موجودات مختلفی مثل zebrafish و موش بیان میشوند. بیان let-7 در سلولهای بنیادی جنینی تمایز نیافته، پایین است اما در طی تمایز به ردههای عصبی افزایش مییابد. در فرآیند همکاری سلولهای بنیادی عصبی، let-7 بخشی از لوپ بازخورد منفی دوگانه است که در سطح بیان let-7 به عنوان کنترلی برای تبدیل سلولهای جنینی به سلولهای عصبی شناخته میشود(شکل ۱).
Abstract
microRNAs, small non-coding RNAs that regulate gene expression at the post-transcriptional level, are emerging as important regulatory molecules involved in the fine-tuning of gene expression during neuronal development and function. microRNAs have roles during neuronal stem cell commitment and early differentiation as well as in later stages of neuronal development, such as dendritogenesis and synaptic plasticity. A link between microRNAs and neurological diseases, such as neurodegeneration or synaptic dysfunction, is becoming increasingly clear. This review summarizes the current knowledge of the function of microRNAs in the developing and adult nervous system and their potential contribution to the etiology of neurological diseases.
Introduction
The discovery of microRNAs (miRNAs) has introduced an important new layer of regulatory control of gene expression. miRNAs are short non-coding RNAs, about 21 nucleotides (nt’s) long, that modulate gene expression at the post-transcriptional level by guiding cellular machinery to the 3 -untranslated region (3 -UTR) of specific messenger RNAs (mRNAs) to control their expression. Since the biogenesis and mechanism of action of miRNAs has been extensively described in other reviews [6,9], it will only be briefly discussed here. Most miRNAs are transcribed by polymerase II, although a few human miRNAs have been shown to be transcribed by polymerase III [8]. The primary transcript (pri-miRNA) can be up to several thousand nt’s long and contains internal hairpin structures. Within the nucleus, the pri-miRNA is processed by the RNase III enzyme Drosha, resulting in a ∼70 nt long hairpin precursor miRNA (pre-miRNA) containing a 2-nt 3 overhang. This overhang is recognized by Exportin-5, which transports the pre-miRNA into the cytoplasm. In the cytoplasm, the pre-miRNA is further cleaved by the RNase III enzyme Dicer. This results in the formation of an intermediary miRNA:miRNA* duplex consisting of the ∼21 nt mature miRNA and its star sequence, miRNA*. Following unwinding of the miRNA duplex by a helicase, the mature miRNA is incor-porated into the RNA-induced silencing complex (RISC), whereas the miRNA* is usually degraded. Binding of a miRNA to its target mRNA requires both RISC and the presence of Argonaute (Ago) proteins. miRNA target recognition usually involves strong basepairing between residue 2–8 at the 5 -end of miRNAs, the so-called seed sequence, and complementary sequences in the 3 -UTR of the target mRNA. Depending on the degree of complementarity between the miRNA and its target, the target mRNA can either be cleaved and degraded or translationally repressed. Perfect complementarity induces degradation of the mRNA, whereas non-perfect complementarity results in translational inhibition. In animals, miRNA silencing of gene expression is predominantly mediated by translational blockade. To date, the mechanisms behind translational inhibition are elusive. Regulation at the step of translational initiation is believed to be the main mechanism to block translation, although evidence for regulation at post-initiation steps has also been put forward [51]. The miRNA induced translational inhibition appears to be reversible in a few instances [7,55], rendering the miRNA mediated regulation dynamic and responsive to specific cellular needs.
Vertebrate miRNA genes either occur as isolated genes or are located in large miRNA clusters that are coordinately transcribed as polycistronic primary transcripts [15]. Non-clustered miRNA genes can be transcribed from their own promoter, though 40% and 10% of human and mouse miRNA genes are located within introns and exons, respectively, of non-protein-coding or protein-coding transcripts and expressed along with their host gene [77].
miRNAs are very abundant in multicellular organisms and influence the expression of many protein-coding genes. To date, approximately 700 miRNAs have been described in the human genome [23] and the number is continuously expanding. Each miRNA has been estimated to target up to a few hundred target genes [33] and, altogether, miRNAs have been suggested to regulate as much as one third of the protein coding genes in animals [38]. miRNAs are divided into families based on similarities in their seed sequences. One-third of miRNA families are highly conserved across species, and as much as 60% conservation between mouse and human mature miRNAs is observed [52]. miRNAs have been implicated in diverse cellular processes such as developmental timing, apoptosis, metabolism, myogenesis and cardiogenesis [31].
Taking into account the high complexity of the brain and its neuronal circuits, it comes as no surprise that miRNAs are emerging as essential regulators of the development and function of the nervous system. miRNA research is still a relatively nascent field, and detailed mechanisms on miRNA involvement in the regulatory circuits of the nervous system are just beginning to be unveiled. This review presents an overview of the current knowledge about the involvement of miRNA regulatory pathways in the function of the developing and adult nervous system and in neurological diseases.
Role of Dicer and microRNAs in the nervous system
The brain is a rich source of miRNAs and several studies using miRNA expression profiling reveal that a significant fraction of miRNAs are enriched or specifically expressed in the nervous system [18,36], and that their expression is precisely regulated during brain development [34,46]. This initially indicated an important role of miRNAs in brain development, neuronal differentiation and regulation of brain and neuron specific gene expression. Genomic Dicer ablation results in the absence of all mature miRNAs and has been used as a valuable tool to study the general involvement of miRNA regulatory pathways in the nervous system. Severe brain morphogenesis deficits are observed in zebrafish Dicer knockout mutants. Lack of Dicer can be rescued by miR-430, a large family of miRNAs expressed during early zebrafish development, implicating an essential role for this miRNA family during brain development [22]. In mice, Dicer ablation causes neurodegeneration and cell death of subpopulations of neurons, such as dopamine neurons in the midbrain [29], postmitotic Purkinje cells of the cerebellum [54] and neocortical neurons [17]. In addition, loss of Dicer in cortex and hippocampus affects cellular and tissue morphology, axonal pathfinding and apoptosis [16]. This indicates that miRNAs are important in such diverse processes as neuronal and tissue morphogenesis, neuronal survival and possibly neurodegenerative diseases. Dicer silencing in neocortical progenitors impairs neuronal differentiation [17] and results in abnormal terminal differentiation of developing olfactory progenitors. Inhibiting the miR-200 family alone, a family of miRNAs highly expressed in olfactory tissue, phenocopies the abnormal terminal differentiation in olfactory progenitors [14]. As a whole, these results indicate a central role for miRNAs during neuronal differentiation.
The studies using Dicer mutants have revealed undoubtedly important roles for miRNAs in many diverse aspects of the nervous system. Nevertheless, the ablation of Dicer does not reveal anything about the function of individual miRNAs. The remaining of this review is focused on the impact of individual miRNAs on developmental and functional aspects of the nervous system.
microRNAs in neural cell lineage specification and differentiation
A number of studies have identified the importance of miRNA regulatory pathways in early events of neuronal development, such as neural stem cell commitment, differentiation and neurite outgrowth. let-7 was originally discovered in Caenorhabditis elegans as a regulator of developmental timing through the regulation of cell proliferation and differentiation [10]. This miRNA is highly expressed in brain tissues of diverse organisms, such as zebrafish and mouse [36,71]. let-7 expression is low in undifferentiated embryonic stem cells, but increases upon differentiation to the neural lineage [53,73]. In the process of neural stem cell commitment, let-7 is part of a double-negative feedback loop where the level of let-7 expression is believed to control the embryonic to neural embryonic stem cell transition (Fig. 1)[53]. Although mature let-7 is not expressed in undifferentiated embryonic stem cells, these cells nevertheless express pre-let-7, suggesting a post-transcriptional regulation of let-7 expression. One candidate regulator is Lin-28 [26,47,53,65], a protein best known for its involvement in developmental timing in C. elegans [10], but which has recently been shown to be involved in reprogramming of human somatic cells to pluripotent stem cells [75]. The Lin-28 mediated negative regulation of let-7 expression occurs through inhibition of let-7 processing events. Evidence for two mechanisms for the Lin-28 mediated inhibition of let-7 processing has been accumulated. Firstly, Lin-28 binds to the loop region of the hairpin structure in the pri-let-7 transcript, thereby blocking Drosha processing [47]. Secondly, Lin28 induces uridylation of pre-let-7 at its 3 end, resulting in a failure of the precursor to undergo Dicer processing [26]. During neural cell lineage specification, Lin-28 and let-7 collaborate in controlling maturation of let-7. Lin-28 is downregulated by let-7 allowing processing of pri/pre-let-7, whereas suppression of let-7 by Lin-28 leads to upregulation of Lin-28 and loss of pri/pre-let-7 processing [53].
چکیده
مقدمه
نقش Dicer و miRNA در سیستم عصبی
miRNAها در اختصاصیت ردههای سلول عصبی و تمایز آنها
microRNAها در تکامل مغز
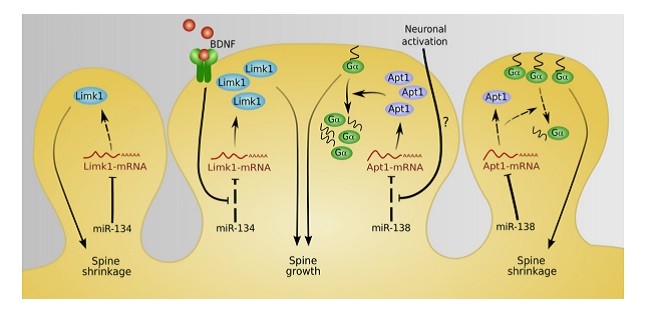
microRNAها در ارتجاع پذیری سیناپسی
تنظیم وابسته به فعالیت microRNAها در سیستم عصبی
miRNAها در تخریب عصبی
نتیجه گیری
Abstract
Introduction
Role of Dicer and microRNAs in the nervous system
microRNAs in neural cell lineage specification and differentiation
microRNAs in brain development
microRNAs in synaptic plasticity
Activity-dependent regulation of microRNAs in the nervous system
microRNAs in neurodegeneration
Conclusion
Acknowledgements
References
