
دانلود رایگان مقاله نشانگرهای زیستی در آسیب کبدی ناشی از مصرف دارو
با اینکه بسیار نادر هستند اما DILI یک شرایط جدی به شمار می آید، هم برای شخص بیمار که در معرض نارسانی حاد کبد قرار میگیرد و هم برای صنعت داروسازی و نهادهای نظارتی که مسئول رسیدگی و نظارت بر توسعه و پیشبرد علوم داروسازی هستند. چنین نهادهایی هستند که باید در صورت نیاز اطلاعات و عوارض جانبی را اطلاع دهند و یا پس از عرضه داروهای زبان بار را از بازار جمع آوری نمایند. محدودیتی جدی در تشخیص و پیش بینی بروز عارضه DILI نبود نشانگرهای زیستی مشخص است. علارغم استفاده گسترده از نشانگرهای زیستی رایج در DILI، هنوز هم تشخیص صحیح و قابل اتکا بسیار دشوار است. این محدودیت ها نیاز به ایجاد نشانگرهای زیستی حساس و دقیقتر برای نشانگرهای زیستی DILI را افزایش داده است. این نشانگرهای زیستی میتوانند تشخیص و پیش بینی و روند درمانی بیماری DILI را ارتقا بخشند. تا امروز چندین نشانگر زیستی قابل توجه برای عارضه DILI معرفی شده اند که از جمله آنها نشانگرهای زیستی مبتنی بر مکانیستیک، برای مثال گلوتامات دهیدروژناز، پروتئین با دسته بندی جابه جایی 1 و کراتین-18، که میتواند اطلاعاتی در رابطه با ماکنیزم آسیب عوامل مسبب مختلف ارائه نماید. علاوه بر اینها، میکرو RNA ها هم به عنوان کاندیدهای نشانگر زیستی DILI غیر تهاجمی، با پتانسیل بالا توجهات بسیاری را به سوی خود جلب کرده اند، اللخصوص miR-122. پیشرفت های حاصل شده در تکنولوژی « omics» هم رویکردی جدید در مطالعات نشانگرهای زیستی ایجاد کرده است. قابلیت مشاهده تعداد بالایی از مولکول ها (برای مثال متابولیت ها، پروتئین و یا DNA) به طور همزمان تشخیص «میزان سمی بودن » را ممکن میسازد که به نوبه خود در ارزیابی های ایمنی و تشخیص بیماری کمک شایان توجهی به شمار میرود. از طرف دیگر مطالعات Omics محور هم میتوانند اطلاعاتی درباره مکانیزمهای ضمنی فرمهای مختلف از عارضه DILI را در راستای سهولت در تشخیص نشانگرهای زیستی معایناتی در مراحل ابتدایی عارضه و پیاده سازی ایمن تر داروهای شخصی سازه شده فراهم نمایند. در این مقاله علمی پیشرفتهای اخیر در حوزه مطالعات نشانگرهای زیستی DILI را مورد بررسی قرار داده ایم.
معرفی
آسیب کبدی ناشی از مصرف دارو (DILI) یکی از واکنش های مضری است که در بخش کوچکی از بیماران پدیدار میشود. عارضه DILI عمدتا در دسته بیماری های ذاتی قرار میگیرد و در صورت پیش بینی بر حسب دز و ویژگی های دارویی دسته بندی میشود (برای مثال اوردز آستامینافون یا APAP) و در صورت عدم پیش بینی ویژه طبقه بندی میشود، با همان ویژگی ها. مورد دوم در نتیجه تعامل با خواص دارویی، فاکتورهای پذیرنده و شرایط محیطی در اشخاص با احتمال ابتلا است. بنابراین، هیچ مدلهای حیوانی دارای کاربردی برای DILI نوع ویژه موجود نیستند، برخلاف وجود مدلهای موشی برای سمیت کبد APAP. عارضه DILI میتواند تاثیر بسزایی بر سلامتی بیمار داشته باشد و نارسایی کبدی حاد ایجاد کند. با این حال اکثر پرونده های DILI ویژه نتیجه ای مطلوب با سرعت بازیابی سلامت بالا پس از خروج داروی مقصر از بدن داشته اند. این عارضه میتواند چالش پزشکی بالایی داشته باشد چون تقریبا میتواند تمامی شرایط حاد و مضمن عارضه کبدی و صفراوی را به خود بگیرد و در حال حاضر هیچ نشانگر زیستی یا تست تشخیصی بخصوصی برای این شرایط وجود ندارد. پس یک تشخیص پزشکی DILI شدیدا وابسته به صرفنظر کردن از علت های جایگزین دیگر و گردآوری یک تاریخچه کامل از مصرف داروهای سازگار است. نبود نشانگرهای زیستی برای این بیماری میتواند به روند پیشبرد دارو نیز تاثیر بگذارد و در نهایت به حذف کاندیدهای دارویی با پتانسیل سمیت کبدی ویژه شود. این امر میتواند عواقب اقتصادی قابل توجهی داشته باشد و باعث شود گروه بزرگی از پذیرندگان دارویی از دستیابی به درمان مورد نیاز شان منع شوند، تنها به این خاطر که دارو برای بخش کوچکی از بیماران مضر است. نشانگرهای زیستی جدید و حساستر برای DILI میتواند نظارت بهتری را بر بیماران تحت درمان با داروهای جدید فراهم کند و آسیب کبدی را با تشخیص زودهنگام و توقف تجویز برطرف سازد.
نشانگرهای زیستی در تشخیص DILI
یک نشانگر زیستی را میتوان یک ویژگی تعریف کرد که به عنوان شاخصی از فرآیند زیستی، فرآیندهای بیماری زا یا پاسخ دارویی به یک مداخله داروویی دانست که میتوان آن را اندازه گیری و ارزیابی نمود. با اینکه نشانگر های زیستی بیشترین اهمیت را در دوره پیش بالینی و آزمونهای پزشکی اولیه و ارزیابی های ایمنی یک داروی جدید دارند، در روند تشخیص بیماری، تعیین مرحله پیشرفت آن و پیش بینی و نظارت بر واکنش دارویی هم حائز اهمیت هستند. در نبود نشانگرهای زیستی مورد نیاز برای DILI، این عارضه با کمک سرم آسیب کبدی نشانگرهای زیستی و به صورت کلی تشخیص داده میشود، از جمله این سرم ها میتوان به آلانین آمینوترانسفراز (ALT)، آسپارتات آمینوترانسفراز (AST)، آلکالن فسفاتاز (ALP) و بیلی روبین (TBL) اشاره کرد. ALT، AST و ALP آنزیم های داخل سلولی هستند که در صورت تشخیص داده شدن در سرم میتوانند آسیب به سلولهای کبدی یا سلول های صفراوی را مشخص کنند. از طرف دیگر یک افزایش در سرم TBL نارسایی کبدی را آشکار میکند، اما با وجود اینکه صرفا برای تشخیص نارسایی کبد استفاده میشود، در عمل کمتر حساسیت نشان میدهد و معمولا در مراحل پیشرفته تر بروز آسیب خود نشان میدهد. ALT، AST و ALP مختص کبد نیستند و شرایط خارج کبدی از جمله آسیب میوکارد، بیماری های اسکلتی عضلانی، هیپرتیروئیدی و بیماری استخوانی هم با افزایش ALT، AST و ALP مرتبط هستند. جالبتر اینکه شواهدی مبنی تاثیر پذیری سطح پلاسمای ALT و ALP به خاطر تفاوت های ژنتیکی در حال کشف شدن است.
آلانین آمینوترانسفراز برای تشخیص آسیب کبدی موثرتر از AST است، چرا که بیشتر به شکل پروتئین سیتوزولی در کبد حضور داشته و غلظت کمتری در جاهای دیگر بدن دارد، در حالیکه AST هم در فرم سیتوزولی و میتوکندری در کبد، قلب، عضلات استخوانی، کلیه، مغز و پانکراس، بافت شش و حتی گلبول های قرمز حضور دارد. در مقابل ALT انسانی در دو ایزوفرم با ظرفیت آنزیم مشابه به هم ALT1 و ALT2 موجود است و حضور ALT2 محدود به بافت های غیر کبدی هم میشود، به طور ویژه عضلات قلب و اسکلت. در مطالعات اخیر چنین یافت شده است که ارزیابی میزان مشارکت فعالیت های ALT1 و ALT2 به کل فعالیت ALT در پلاسما آسیب های کبدی را از غیر کبدی جدا میکند. استفاده از سنجش میزان فعالیت ALT استاندارد در حال حاضر در روش های پزشکی استفاده میشود، هر چند هیچ تمایزی بین سرم ALT و سایر ارگان ها و یا ایزوفرم ها قائل نمیشود.
فنوتایپ بیماری
آسیب کبدی ناشی از مصرف دارو خود به سه دسته ازالگوهای آسیب های کبدی تقسیم میشود (هپاتوسلولار، کلستاز، و ترکیبی)، این دسته بندی در اصل وابسته به ویژگی های بافتشناسی است. آسیب های هپاتوسلولار معمولا ریشه در نکروز سلولهای کبدی و التهاب دارند، در حالیکه استاز صفرا، التهاب پورتال و آسیب مجرای صفراوی معمولا در آسیب های کلستاز دیده میشوند. آسیب ترکیبی هم همانطور که از نامش پیداست ترکیبی از دو آسیب دیدگی کبدی فوق الذکر است. از آنجایی که بیوپسی معمولا تشکیل دهنده بخشی از روند تشخیص DILI نیستند، الگوی آسیب معمولا از روی معیارهای تحلیلی خصوصیات کبد به دست می آید. دقیق تر اینکه رابطه بین معیارهای ALT و ALP در زمان شروع عارضه DILI برای تعیین نوع آسیب کبدی مطابق با فرمول R به کار میروند.
R= (ALT/محدوده بالای نرمال ULN) ^) ALP/ULN)
یک مقدار R بزرگتر از 5 نشاندهنده آسیب هپاتوسلولار است، مقدار R < 2 آسیب کلستاز و مقدار 2 < R < 5 آسیب ترکیبی را نشان میدهد. مقایسه اخیر بین نوسانات ALT و AST در گروه بزرگی از بیماران DILI نشان میدهد که AST میتواند جایگزین خوبی برای ALT در محاسبات مقدار R باشد، مخصوصا در مواردی که مقادیر ALT در آنست DILI غایب هستند، اما گاما گلوتامیل ترانس پپتیداز (GGT) کمتر از جایگزین های ALP قابل اتکا است.
روند درمانی و پیش بینی
مقدار ALT به تنهایی میتواند ارزش پیش بینی کمی در رابطه با روند درمانی DILI داشته باشد اما در ترکیب با TBL میتواند شاخص پیش بینی خوبی ارائه کند. امروزه به این یافته قانون «های» گفته میشود و بر پایه یافته های پزشکی محقق فقید هایمن زیمرمان بر روی بیماران مبتلا به DILI از نوع آسیب هپاتوسلولار است. طبق این یافته زردی در حدود 10-50% ریسک میزان خطر را بسیار بالا میبرد و نیاز به پیوند کبد وجود دارد. در غیاب ALP قانون های AST و یا مقدار ALT بیشتر از سه برابر ULN و TBL بیشتر از 2 برابر ULN را تعریف میکند و همچنین جایگزینی برای ارزیابی های ALT و TBL. به همین خاطر هم از سوی وزارت غذا و داروی آمریکا به عنوان معیاری برای عارضه حاد DILI تعیین شده است.
میزان اعتبار قانون های در بسیاری از گروه های مبتلایان به عارضه DILI تایید شده است. هر چند افزایش های ALP در قانون های بارها زیر سوال برده شده است و یافته های اخیر نشان میدهند که یک سطح ALP بالاتر از 2 برابر ULN نقشی حفاظتی در پیشرفت نارسایی حاد کبدی ندارد. با وجود حساسیت بالا قانون های فاید ویژگی کافی است و اکثر موارد DILI مطابق با معیارهای قانون های نتیجه درمان کامل مطلوبی از خود نشان میدهند. با استفاده از طیف گسترده تر از معیارهای تحلیلی ما الگوریتم ترکیبی با ویژگی بالاتر برای پیش بینی نارسایی حاد کبدی بر اساس آنست داده DILI ارائه کرده ایم.
نشانگرهای زیستی مستعد برای عارضه DILI
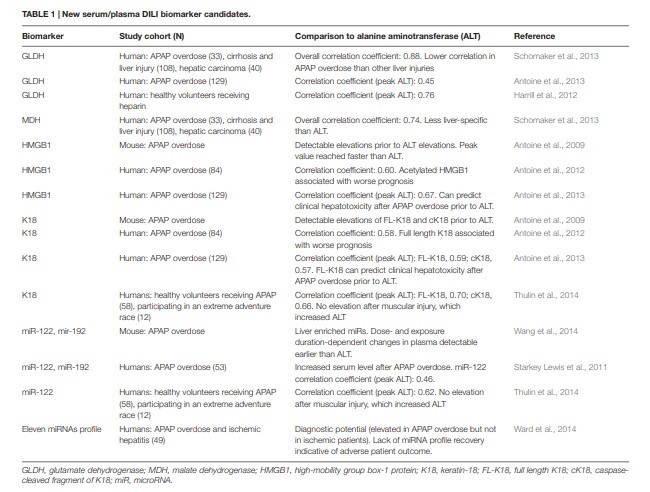
توجه بیشتر در ساخت نشانگرهای زیستی DILI حساستر و ویژه تر برای تشخیص و پیش بینی زودهنگام منجر به کشف چندین کاندید مستعد شده است (جدول 1). بسیاری از این کاندیدها در اصل به عنوان مدل های APAP شناسایی شده اند، اما میتوانند برای جنبه های ویژه عارضه DILI هم مناسب باشند.
Despite being relatively rare, drug-induced liver injury (DILI) is a serious condition, both for the individual patient due to the risk of acute liver failure, and for the drug development industry and regulatory agencies due to associations with drug development attritions, black box warnings, and postmarketing withdrawals. A major limitation in DILI diagnosis and prediction is the current lack of specific biomarkers. Despite refined usage of traditional liver biomarkers in DILI, reliable disease outcome predictions are still difficult to make. These limitations have driven the growing interest in developing new more sensitive and specific DILI biomarkers, which can improve early DILI prediction, diagnosis, and course of action. Several promising DILI biomarker candidates have been discovered to date, including mechanistic-based biomarker candidates such as glutamate dehydrogenase, high-mobility group box 1 protein and keratin-18, which can also provide information on the injury mechanism of different causative agents. Furthermore, microRNAs have received much attention lately as potential non-invasive DILI biomarker candidates, in particular miR-122. Advances in “omics” technologies offer a new approach for biomarker exploration studies. The ability to screen a large number of molecules (e.g., metabolites, proteins, or DNA) simultaneously enables the identification of ‘toxicity signatures,’ which may be used to enhance preclinical safety assessments and disease diagnostics. Omics-based studies can also provide information on the underlying mechanisms of distinct forms of DILI that may further facilitate the identification of early diagnostic biomarkers and safer implementation of personalized medicine. In this review, we summarize recent advances in the area of DILI biomarker studies.
INTRODUCTION
Drug-induced liver injury (DILI) is one of many forms of adverse drug reactions that appear in a small proportion of patients. DILI is generally classified as intrinsic if predictable based on dose and pharmacological properties [for example acetaminophen (APAP) overdose] or idiosyncratic when unpredictable by the same features. The latter is believed to be a consequence of interactions between drug properties, host factors, and environmental conditions in a susceptible individual. Hence, no functional animal models are currently available for idiosyncratic DILI, unlike the presence of well-established murine models for APAP hepatotoxicity. DILI can have a profound impact on patient health due to its potential to cause acute liver failure, although most idiosyncratic DILI cases have a favorable outcome with full recovery after withdrawal of the culprit drug. DILI presents a clinical challenge as it can mimic almost any acute or chronic hepatobiliary condition and there are currently no specific biomarkers or diagnostic test available for this condition. A clinical diagnosis of idiosyncratic DILI therefore relies heavily on exclusion of alternative causes and a compatible drug history. The lack of DILI specific biomarkers also affects the drug development process and can result in early termination of drug candidates with assumed idiosyncratic hepatotoxicity potential. This can have considerable economic consequences and can prevent a large targeted recipient group from benefitting from a drug that may only be harmful to a small proportion of patients. New more specific and sensitive DILI biomarkers could enable better monitoring of patients receiving new drugs and minimize liver injury through early detection and subsequent cessation of dosing.
CURRENT BIOMARKERS IN DILI
Diagnosis
A biomarker is defined as a characteristic that is objectively measured and evaluated as an indicator of normal biological processes, pathogenic processes or pharmacologic responses to a therapeutic intervention (Biomarkers Definitions Working Group, 2001). While of uttermost importance in preclinical and early-phase clinical trial efficacy and safety evaluations of new drug compounds, biomarkers also play important roles in clinical practice to diagnose specific diseases, determine the state of a disease, disease prognosis and monitoring of clinical response to an intervention. Due to the lack of specific DILI biomarkers, DILI is monitored and diagnosed based on general liver injury serum biomarkers, such as alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP), and total bilirubin (TBL). ALT, AST, and ALP are all intracellular enzymes, which when detected in serum can indicate injury to hepatocytes or biliary cells. An increase in serum TBL on the other hand reflects liver dysfunction, but while being liverspecific it is relatively insensitive and subsequently appears later along the disease progression. ALT, AST, and ALP are not liverspecific and extrahepatic conditions such as myocardial damage, skeletal muscle diseases, hyperthyroidism, and bone diseases are associated with increased ALT, AST, or ALP. Interestingly, evidence of ALT and ALP plasma levels being influenced by genetic variations are also emerging (Yuan et al., 2008).
Alanine aminotransferase is thought to be more specific for liver injury than AST, as it is present mainly as a cytosolic protein in the liver and in low concentrations elsewhere, while AST is present in both cytosolic and mitochondrial forms in liver, heart, skeletal muscle, kidney, brain, pancreas, and lung tissue as well as in white and red blood cells (Giboney, 2005). Human ALT, however, exists as two isoforms with identical enzyme capacity, ALT1 and ALT2, although the presence of ALT2 appears to be restricted to non-hepatic tissue, in particular heart and skeletal muscles (Glinghammar et al., 2009). A recent study has demonstrated that assessing the percentage contribution of ALT1 and ALT2 activities to total ALT activity in plasma may distinguish hepatic from extrahepatic injury (Rafter et al., 2012). The standard ALT activity assay currently used in clinical practice, however, does not discriminate between serum ALT from different organs or isoforms.
Disease Phenotype
Drug-induced liver injury is generally classified into three patterns of liver injury (hepatocellular, cholestatic, and mixed), based originally on histological features. Hepatocellular type of injury is characterized by hepatocyte necrosis and inflammation, while bile stasis, portal inflammation and bile duct injury are commonly found in cholestatic injury. Mixed injury is, as the name suggests, a combination of these two liver injury types. As biopsies not normally form part of the DILI diagnostic process, the pattern of injury is mainly deduced based on liver profile analytical values. More precisely, the relationship between ALT and ALP values at DILI onset are used to determine the type of liver injury according to the R formula, R = (ALT/upper limit of normal, ULN) ÷ (ALP/ULN; Benichou, 1990; Aithal et al., 2011). An R value ≥ 5 is indicative of hepatocellular damage, R ≤ 2 cholestatic damage and 2 < R < 5 mixed damage. A recent comparison of ALT and AST elevations in a large DILI cohort found that AST can reliably substitute for ALT in R value calculations in cases were ALT values are absent at DILI onset, but that gamma-glutamyl transpeptidase (GGT) is less reliable as an ALP substitute (Robles-Diaz et al., 2015).
Clinical Course and Prognosis
An ALT value alone offers little predictive value with regards to the clinical course of DILI, but can provide a prognostic indication when combined with TBL. This is today referred to as Hy’s Law and is based on clinical observations made by the late Hyman Zimmerman that DILI patients with hepatocellular type of liver injury and jaundice have a 10–50% higher risk of mortality or need for liver transplantation. Hy’s Law has since been defined more specifically as AST or ALT > 3 xULN and TBL > 2 xULN in the absence of ALP elevations and alternative reasons for ALT and TBL elevations, and is endorsed by the American Food and Drug Administration as criteria for severe DILI1 .
The validity of Hy’s Law has now been confirmed in various large DILI cohorts (Andrade et al., 2005; Björnsson and Olsson, 2005; Chalasani et al., 2015). However, the effect of ALP increases on Hy’s Law have been questioned and recent findings demonstrate that an ALP level greater than 2 xULN does not have a protective role in acute liver failure development (Robles-Diaz et al., 2014). While having relatively high sensitivity, Hy’s Law lacks specificity as the majority of DILI cases meeting the Hy’s Law criteria in fact have a favorable outcome with full recovery. Using an extended range of analytical values we have developed a composite algorithm with higher specificity for the prediction of acute liver failure based on DILI onset data (Robles-Diaz et al., 2014).
NEW POTENTIAL BIOMARKERS IN DILI
The heightened interest in developing new more sensitive and specific DILI biomarkers for early prediction and diagnosis2,3,4 has resulted in the discovery of several promising candidates (Table 1). Many of these biomarker candidates were initially identified using APAP models, but could also be promising for aspects of idiosyncratic DILI.
معرفی
نشانگرهای زیستی در تشخیص DILI
تشخیص
فنوتایپ بیماری
روند درمانی و پیش بینی
نشانگرهای زیستی مستعد برای عارضه DILI
مبتنی بر مکانیستیک
MicroRNA
اگزوسومز
نشانگرهای زیستی مشتق شده از «امیکز »
چشم اندازهای آینده
منابع
INTRODUCTION
CURRENT BIOMARKERS IN DILI
Diagnosis
Disease Phenotype
Clinical Course and Prognosis
NEW POTENTIAL BIOMARKERS IN DILI
Mechanistic-Based
MicroRNA
Exosomes
“Omics” Derived Biomarkers
FUTURE PERSPECTIVES
REFERENCES
